|
Discusión del
caso clínico
Dra. Fernanda Otal
A modo de resumen del paciente en discusión podemos decir que se trata de un hombre, adulto joven, con antecedentes de hipertensión arterial y dislipemia, ex tabaquista y ex etilista, con diagnóstico ya clínico, imagenológico y anatomopatológico de necrosis óseas avasculares (NOA) múltiples, motivo por el cual en el transcurso de estos últimos 10 años realizó múltiples consultas a especialistas, con múltiples metodologías diagnósticas y fue sometido a múltiples medidas terapéuticas.
A pesar de todo esto, no se ha podido llegar al diagnóstico etiológico y es un paciente que persiste con dolor crónico.
Para guiar mi discusión, voy a desarrollar en primer lugar las posibles etiologías de la necrosis avascular, para luego plantear el tratamiento a seguir, siempre en el contexto y no perdiendo la visión global de un paciente con dolor crónico.
Para introducirnos en el tema, sabemos que la necrosis ósea avascular, encontrada en la literatura también como necrosis ósea aséptica u osteonecrosis, es una enfermedad que afecta las epífisis y tiene predilección por las cabezas femoral y humeral, cóndilos femorales, epífisis proximal de la tibia y huesos largos de pies y manos.
En EEUU se presenta con una incidencia de 10.000 a 20.000 casos nuevos por año representado el motivo del 10% de las artroplastias de cadera realizadas.
Se presenta en una relación hombre:mujer de 8:1 y la edad promedio de presentación es entre los 30 y los 50 años.
Si bien la fisiopatogenia no está aun completamente dilucidada, se cree que existen factores involucrados como factores metabólicos, daño vascular, aumento de la presión intraósea y estrés mecánico.
Como podemos observar a continuación, la lista de las posibles causas de NOA es extensa; asociándose en el 90% de los casos a esta patología con el tratamiento corticoideo y el etilismo.
TRAUMÁTICAS
- Fractura
- Luxación
- Microtraumas
NO TRAUMÁTICAS
- Tratamiento con corticoides
- Etilismo
- Anemia Drepanocítica
- Enfermedad de Caisson (disbarismo)
- Lupus Eritematoso Sistémico
- Enfermedad de Gaucher
- Insuficiencia renal. Hemodiálisis
- Pancreatitis
- Embarazo
- Dislipemia
- Radiación
- Trasplante de órganos
- Coagulación intravascular
- Trombofilias
- Tabaquismo
- Hiperuricemia/gota
- Infección por VIH
- Idiopática
A través de la anamnesis muchas de estas causas pueden ser ya descartadas.
De todas maneras, en más de una ocasión no encontramos una causa clara o, como en el caso de nuestro paciente, varios factores asociados. Es aquí cuando surge la denominada teoría del “estrés celular acumulado” que atribuye la necrosis a la coexistencia de varios factores de estrés. Esto explicaría en parte por ejemplo la baja incidencia de ON por corticoides en pacientes sin otros factores de riesgo.
Luego de descartar algunas causas con el interrogatorio, la lista queda más acotada y en el transcurso de estos 10 años muchas posibles patologías asociadas fueron estudiadas y descartadas.
- En cuanto a la anemia drepanocítica, es la hemoglobinopatía más frecuente. Lo que se produce es una alteración en la cadena de globina, lo que distorsiona la estructura de los eritrocitos y aumenta la viscosidad sanguínea.
El 50% de los pacientes con anemia drepanocítica presentará un episodio de NOA hacia los 35 años de edad.
De todas maneras, al no presentar el paciente ni anemia crónica, ni episodios de hemólisis ni crisis vaso-oclusivas considero a ésta una asociación alejada.
- En cuanto al Lupus Eritematoso Sistémico (LES), la NOA puede presentarse en entre un 10 hasta un 30% de los pacientes y por lo general se da en aquellos que además presentan otros factores asociados, como ser el tratamiento con corticoides (prednisona >20 mg/día), fenómeno de Raynaud, dislipemia o Síndrome Antifosfolipídico.
No presentando el paciente manifestaciones clínicas compatibles con LES y además FAN, anti-ADN y anticardiolipinas negativos la asociación se considera alejada.
- Para continuar con las posibles asociaciones, en cuanto a la Enfermedad de Gaucher, ésta es una enfermedad hereditaria, autosómica recesiva, caracterizada por el déficit de la enzima beta glucocerebrosidasa, es una enfermedad de depósito y se cree que el depósito a nivel de la médula ósea produce compresión vascular y la posterior osteonecrosis. El 60% de los pacientes va a presentar NOA. Pero en este paciente que no ha presentado otras manifestaciones clínicas, no tiene hepatoesplenomegalia ni alteraciones hematológicas, y se han determinado los valores de betaglucosidasa y de quitotriosidasa (siendo éstos normales) la asociación la considero alejada.
Hasta ahora vimos las causas descartadas en el paciente en discusión, y si bien no puedo asegurar que las siguientes sean el motivo de sus NOA, sí se han reportado en la literatura asociaciones.
- En cuanto al hábito etílico, si bien la fisiopatogenia es desconocida y se supone la asociación de microémbolos grasos, estasis venosa o aumento de la concentración de cortisol, hay estudios que confirman la asociación.
En este primer trabajo “Influence of alcohol intake, cigarette smoking, and occupational status on idiopathic osteonecrosis of the femoral head” (1) se estudió la influencia del etilismo, tabaquismo y el trabajo ocupacional en relación a la NOA. Se compararon 112 pacientes que ingresaron con NOA idiopática, sin antecedentes de consumo de corticoides, con 168 pacientes controles. Si bien no se encontró relación con el trabajo y el tabaquismo, sí se asoció al etilismo e incluso riesgo aumentado directamente proporcional a la cantidad de alcohol consumida.
- La dislipemia es otro de los factores que suelen asociarse a NOA, en principio podría deberse a microémbolos grasos o a ateromatosis.
Es por esto que planteo a ambas como asociaciones posibles.
- En cuanto a las trombofilias, otra de las posibles asociaciones, el 40 a 50% van a corresponder a mutaciones del Factor V de Leiden.
Muchas de ellas ya fueron descartadas en el paciente en discusión, pero propongo completar el estudio. A favor de esto, se encuentran en la bibliografía múltiples presentaciones.
- En este primer trabajo, “Procoagulants and osteonecrosis” (2), se estudiaron 45 pacientes con diagnóstico de NOA y se compararon resultados con 40 pacientes controles sanos. En los pacientes con NOA se identificaron LES (n:9), Enfermedad Inflamatoria del Intestino (n:1), CTC (n:20), etilismo (n:4), tabaquismo (n:3) e idiopática (n:5). En todos ellos se estudiaron 9 factores de la coagulación, y en el 82.2% se encontró una coagulopatía (en comparación con el 30% de los controles) y en todos los casos considerados como idiopáticos se halló una alteración.
- En este segundo trabajo, “Factor V leiden and prothrombin gene mutation: risk factors for osteonecrosis of the femoral head in adults” (3), se propuso determinar si la mutación del gen del factor V de Leiden y la mutación del gen de la protrombina pueden ser considerados factores de riesgo para NOA y además si en los pacientes con dicha mutación los eventos tromboembólicos son más frecuentes. Se involucraron a 65 pacientes con NOA y de los 35 considerados como de causa idiopática 10 presentaron una de estas alteraciones. Las mutaciones fueron más frecuentes en pacientes con NOA si las comparamos con el grupo control sano y además los eventos tromboembólicos eran más frecuentes en esta población también.
- Y este último, “Antithrombin III deficiency in a patient with multifocal osteonecrosis” (4), es la presentación de un caso de una paciente de 35 años de edad, con diagnóstico de déficit de antitrombina III y episodios de NOA múltiples.
Por todo esto es que considero a la trombofilia como una asociación posible.
Ahora bien, ¿cuáles serían las conductas a seguir al finalizar el estudio de trombofilia?
- En caso de no llegar al diagnóstico de trombofilia, no pudiendo determinar que estos episodios de NOA correspondan a eventos trombóticos, más aun en ausencia de otros eventos trombóticos, con un laboratorio negativo y con los riesgos que conlleva la anticoagulación no propongo tratamiento anticoagulante.
- Por otro lado, ante un resultado positivo en los estudios restantes ¿anticoagularíamos al paciente?
Queda clara la anticoagulación ante un evento trombótico, la que debe prolongarse por un período de 3 a 6 meses. De todas maneras, hay estudios que plantean el riesgo que conlleva la anticoagulación por largo plazo y esta anticoagulación prolongada sólo se reserva para pacientes de alto riesgo. (5)
Son considerados pacientes de alto riesgo aquellos que presenten:
- Dos o más trombosis espontáneas o una trombosis espontánea + SAF o Déficit de Antitrombina.
- Una trombosis espontánea con riesgo de muerte.
- Una trombosis espontánea en un sitio inusual.
- Una trombosis espontánea asociada a más de un defecto genético predisponente a un evento trombótico.
Ahora bien, me pregunto nuevamente, ¿corresponderán estas NOA a eventos trombóticos? De todas maneras, teniendo en cuenta que se van adicionando con el correr de los años y se está convirtiendo para el paciente en una enfermedad incapacitante, me plantearía sí en este caso la anticoagulación.
Habiendo mencionado ya las posibles causas de NOA, no olvidemos que nos encontramos con un paciente con NOA múltiples, definiendo éstas como NOA en 3 o más territorios y se da sólo en un 3% de los pacientes con NOA. Por lo general se asocian a tratamiento corticoideo, LES o pacientes trasplantados, no dándose ninguna de éstas circunstancias en el paciente en cuestión.
Entonces, resumiendo hasta aquí, tenemos un paciente con NOAM y en el cuál encontramos factores que posiblemente se relacionen, como el tabaquismo, el etilismo y la dislipemia y además todavía en estudio por trombofilia.
Debemos definir ahora que tratamiento podemos ofrecerle (6).
El tratamiento de la NOA es uno de los temas más controversiales de la literatura ortopédica.
El mismo se basa en tres pilares:
- Manejo conservador:
- Descarga de la articulación (no modifica la evolución natural de la enfermedad).
- Tratamiento analgésico.
- Bifosfonatos: los estudios son preliminares hasta el momento y no se ha definido aún si los bifosfonatos demoran o previenen el colapso articular.
- Procedimientos preservadores:
- Forage: Descompresión central por perforación. Utilizado en estadios precoces, con lesiones poco extensas.
- Injerto de médula ósea.
- Osteotomía.
- Reemplazo articular.
Para definir de qué tratamiento va a ser pasible nuestro paciente, es necesario determinar en primera instancia en qué estadio de la enfermedad se encuentra. Para esto, nos vamos a valer de la clasificación de ARCO.
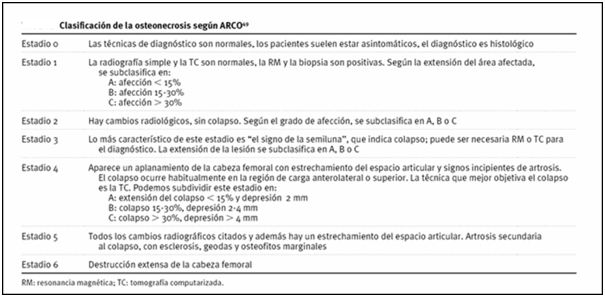
El paciente en discusión presenta a nivel de cabeza femoral lesiones en estadio 2, lo que lo hace pasible de tratamiento con procedimientos preservadores. Por otra parte, a nivel de cabeza humeral el tratamiento de preferencia es el conservador, limitando los procedimientos quirúrgicos a estadios avanzados con colapso articular.
Y hasta aquí hemos hablado del tratamiento específico de la NOA, pero poco hemos dicho del paciente.
No olvidemos que es un paciente con una historia de 10 años de enfermedad y no olvidemos tampoco cómo el dolor crónico lo afecta.
Planteo en él entonces un modelo de intervención multimodal, que abarque no sólo medidas farmacológicas, sino también psicoterapéuticas y rehabilitadoras.
Muchos hablan de DOLOR TOTAL como la suma de la sensación nociceptiva + aspectos psicológicos, sociales y espirituales.
Es importante destacar que un abordaje parcial explica muchos fracasos terapéuticos (7).
Hablando más específicamente ahora del tema dolor, me pareció importante recalcar algunas recomendaciones:
- Evaluar detalladamente el dolor.
- Reevaluar continuamente la respuesta analgésica, así como de la aparición de efectos secundarios de la medicación.
- Abordar a la persona con dolor y su entorno mediante técnicas psicosociales y tratamientos analgésicos adecuados.
- Comenzar por el escalón analgésico más adecuado según el tipo e intensidad de dolor.
- No usar de forma conjunta opioides potentes y débiles.
- Adelantarse a posibles efectos secundarios de los fármacos con medidas preventivas.
- Instruir al paciente y a su familia sobre las pautas a seguir en caso de dolor irruptivo, respuesta analgésica insuficiente o aparición de efectos secundarios.
- Impartir instrucciones claras sobre la forma de contacto con el equipo profesional que atiende al paciente en caso de dudas o problemas con el tratamiento.
- Priorizar la vía oral para la administración de analgésicos.
- Disponer la administración pautada de analgésicos.
Y a la hora de elegir la analgesia, nos podemos valer de la escala propuesta por la OMS. Nuestro paciente, luego de años de tratamiento con diclofenac sin lograr una respuesta terapéutica adecuada, actualmente se encuentra en tratamiento con tramadol y paracetamol como coadyuvante, con mejor manejo del dolor.
Ahora para finalizar, y a modo de resumen, tenemos a un paciente con un cuadro de larga evolución de NOAM, que concurre a nosotros en busca del diagnóstico.
En cuanto a la etiología, destacamos varios factores que pueden asociarse, no olvidando tampoco el porcentaje (no menor) que resultan idiopáticas.
Por otra parte, evaluemos siempre a este paciente en el contexto de una enfermedad crónica, considerando las repercusiones que puede traer. Por eso propongo:
- Tratamiento hipolipemiante
- Bifosfonatos
- Evitar hábitos etílico y tabáquico
- Completar el estudio de trombofilia y, de arribar a un diagnóstico, iniciar tratamiento anticoagulante.
- Tratamiento del dolor
- Psicoterapia.
BIBLIOGRAFÍA
- Matsuo K, Hirohata T, Sugioka Y, et al. Influence of alcohol intake, cigarette smoking, and occupational status on idiopathic osteonecrosis of the femoral head. Clin Orthop Relat Res 1988; :115.
- Jones LC, Mont MA, Le TB, et al. Procoagulants and osteonecrosis. J Rheumatol 2003; 30:783.
- Björkman A, Svensson PJ, Hillarp A, et al. Factor V leiden and prothrombin gene mutation: risk factors for osteonecrosis of the femoral head in adults. Clin Orthop Relat Res 2004; :168.
- Kubo T, Tsuji H, Yamamoto T, Nakahara H, Nakagawa M, Hirasawa Y. Antithrombin III deficiency in a patient with multifocal osteonecrosis. Clin Orthop Relat Res. 2000 Sep;(378):306-11.
- Christiansen SC, Cannegieter SC, Koster T, Vandenbroucke JP, Rosendaal FR. Thrombophilia, clinical factors, and recurrent venous thrombotic events. JAMA. 2005 May 18;293(19):2352-61.
- José a. Gómez-puerta, pilar peris y núria guañabens. Osteonecrosis múltiple. Patogénesis, características clínicas y tratamiento. Seminarios de la Fundación Española de Reumatología. Vol. 8 / Núm 4 - pp. 185-92 / 2007
- Breitbart W, Payne D, Passik SD. Psychological and psychiatric interventions in pain control. In: Doyle D, Hanks G, Chreney N, Calman K, editors. Oxford Textbook of Palliative Medicine. Third ed. Oxford: Oxford University Press; 2004.
|
|
|
Discusión |
|
La discusión de este seminario
corresponde al 6 de Diciembre de 2012, a
cargo de Dra. Fernanda Otal |
|
| |
|
|
| |
|
|
|
|
|