|
Discusión del
caso clínico
Dra. Marianela Lasagna
Voy a discutir el caso de un paciente varón, ex – tabaquista, insuficiente renal crónico con diagnóstico de nefropatía membranosa que se presenta con un síndrome de vena cava superior, objetivando en el laboratorio VES > 100 mm/1er hora , en la TC de tórax adenopatías mediastinales y en la VEDA várices esofágicas.
Las várices esofágicas “down hill”(cuesta abajo) son una complicación de la obstrucción de VCS. Son poco comunes y su desarrollo depende de la duración y el sitio de obstrucción. Si la lesión es proximal a la vena ácigos, el drenaje puede ocurrir a través de las colaterales mediastinales al sistema ácigos por debajo del nivel de obstrucción. Este flujo venoso “cuesta abajo” a través de los vasos esofágicos resulta en la formación de várices esofágicas limitadas a la porción superior del esófago. Si la obstrucción se encuentra distal a la vena ácigos, el sistema ácigos es incapaz de sortear la lesión. El drenaje venoso a través del plexo esofágico causa la formación de várices a lo largo de toda la longitud del esófago.
Como puntos a abordar en la misma propongo:
- Probables etiologías del síndrome de vena cava superior
- Metodología diagnóstica
- Necesidad de tratamiento con colocación de stent endovascular
- Relación entre cuadro actual y diagnóstico previo de nefropatía membranosa
El síndrome de vena cava superior fue descripto por primera vez por el físico y anatomista escocés William Hunter en 1757 en un paciente de 39 años que falleció como consecuencia de un aneurisma de aorta sifilítico.
Incluye signos y síntomas secundarios a compresión externa u obstrucción interna de vena cava superior. Puede desarrollarse por 3 mecanismos: invasión, compresión externa o trombosis (ésta última principalmente asociada al uso de catéteres venosos centrales).
Las manifestaciones clínicas van a depender de la velocidad de instalación del cuadro, pero incluyen cianosis, plétora facial, circulación colateral, edema en esclavina. Puede verse comprometida la vía respiratoria y su más seria consecuencia es el edema cerebral.
En la era pre-antibiótica el aneurisma de aorta sifilítico, la mediastinitis fibrosante y otras complicaciones de infecciones no tratadas constituían frecuentes causas de SVCS.
Actualmente las enfermedades malignas constituyen la causa más importante, alcanzando en algunas series hasta el 90% de los casos. El cáncer de pulmón de células no pequeñas (adenocarcinoma, carcinoma escamoso y carcinoma de células grandes) es la etiología neoplásica más frecuente del SVCS seguido por el carcinoma de células pequeñas (25%) y el linfoma no Hogdkin (10%). Otras entidades como el mesotelioma, teratoma, tumores germinales y metástasis se asocian de forma menos frecuente al SVCS.
Las etiologías infecciosas e inflamatorias abarcan entre 10-40%. Las trombosis corresponden a una proporción importante, esto se debe principalmente al uso de catéteres venosos centrales para la realización de hemodiálisis y quimioterapia. Si bien nuestro paciente ha presentado múltiples accesos venosos centrales, la trombosis ha sido descartada mediante la flebografía que demuestra que la compresión es extrínseca.
Dentro de las causas benignas hasta un 50% pueden ser atribuidas a la mediastinitis fibrosante: un cuadro poco común causado por proliferación de tejido colágeno y fibrótico con compromiso de estructuras mediastinales). Si bien en la mayoría de los casos, la etiología permanece desconocida, se cree que hay una asociación con las infecciones granulomatosas (principalmente por Histoplasma capsulatum), cobrando en nuestro medio especial importancia el Mycobacterium tuberculosis. Coincidiendo con el cuadro de nuestro paciente cuando genera compromiso de estructuras vasculares causando un SVCS presenta un lento desarrollo durante años con presentaciones oligo u asintomáticas, al permitir el desarrollo de circulación colateral. Sin embargo, en la TC tórax no se evidencia ningún proceso infiltrativo a nivel mediastinal, que habitualmente suele presentar lesiones calcificadas, siendo éste el principal estudio de imágenes para arribar al diagnóstico (la RMI es más sensible para determinar la extensión del proceso, pero es menos útil para objetivar lesiones calcificadas). Cuando no hay lesiones típicas el diagnóstico debe ser histológico. A favor de este cuadro tenemos el lento desarrollo del cuadro clínico, que dentro de las causas no malignas es la más frecuente; en contra la ausencia de lesiones en las imágenes, la edad y que es un cuadro raro.
En cuanto a la histoplasmosis en pacientes inmunocompetentes suele transcurrir de forma asintomática. Puede tener un curso agudo o crónico y presentarse con compromiso pulmonar o sistémico. Parece un diagnóstico bastante alejado, ya que como únicos datos a favor el paciente presenta adenopatías mediastinales, derrame pleural y pericárdico. En contra del mismo no tiene compromiso pulmonar (que suele estar presente cuando hay adenopatías mediastinales, ya sea en forma de infiltrados o cuando el curso es crónico con lesiones cavitadas), fiebre, y pensando en compromiso sistémico no hay lesiones cutáneas ni visceromegalias y tanto en la VEDA como en la colonoscopía no se evidenció afección compatible con este cuadro.
Si bien la linfadenitis tuberculosa más frecuentemente compromete los ganglios cervicales, también puede presentarse con afección exclusivamente mediastinal. A favor de este cuadro tenemos la alta prevalencia en nuestro medio, las adenopatías mediastinales y VES > 100, lo que iría en contra es la presencia del SVCS, el cual es más habitual que se presente asociado a la tuberculosis cuando esta se manifiesta como mediastinitis fibrosante. Considero que la tuberculosis es un diagnóstico a descartar.
Sin embargo considero que en nuestro paciente la etiología más probable del SVCS es neoplásica y como principales diagnósticos propongo el linfoma no Hogdkin y el cáncer de pulmón.
En cuanto al cáncer de pulmón entre 2-4% de los pacientes con cáncer de pulmón desarrollarán SVCS en algún punto del curso de su enfermedad, siendo la causa más frecuente. El carcinoma de células pequeñas es el que más se asocia al SVCS (hasta 10% de casos), debido a su localización central con rápido crecimiento y presencia de adenopatías mediastinales (como presenta nuestro paciente). A favor de esta etiología, el paciente tiene el antecedente de tabaquismo, la edad y el sexo coinciden con la máxima incidencia, presenta adenopatías mediastinales en la TC tórax, en contra por tratarse de una topografía central no presenta síntomas y pensando que el tipo histológico más probable podría ser un carcinoma de células pequeñas que es un tumor muy agresivo, de crecimiento rápido y que se disemina fácilmente, no parece coincidir con el cuadro clínico del paciente. Sin embargo, creo que es un diagnóstico probable basándome en los antecedentes del paciente, la epidemiología, las imágenes y por ser ésta la etiología que más frecuentemente se asocia al SVCS.
Dentro de los linfomas, el linfoma no Hogdkin se encuentra asociado en 2-4% de los casos con SVCS. Por razones no del todo claras, el linfoma de Hogdkin raramente es causa de SVCS a pesar de que comúnmente se presenta en forma de adenopatías mediastinales. A favor de esta etiología tenemos la edad y el sexo del paciente, el derrame pleural y pericárdico y las adenopatías mediastinales (que pueden hallarse hasta en el 20% de los casos); en contra de este diagnóstico el paciente no presenta síntomas constitucionales, no tiene visceromegalias y la única citopenia que presenta es una anemia compatible con patrón de enfermedades crónicas que me pregunto que podría estar asociada a su falla renal crónica. Sin embargo, considerando que éstos últimos datos no excluyen el diagnóstico y que es la 2da causa más frecuente de SVCS, lo considero un diagnóstico probable.
Otras neoplasias se asocian menos frecuentemente al SCVS. Las lesiones metástasicas suelen presentarse de forma secundaria a un cáncer de mama, los tumores germinales afectan principalmente a varones < 40 años, para pensar en timoma no tenemos imágenes compatibles en la TC tórax y suele asociarse de manera frecuente a síndromes paraneoplásicos (50-60%) como son la miastenis gravis y la anemia aplásica que no presente nuestro paciente, aunque la edad de presentación coincide con la del mismo y predomina en el sexo masculino . El mesotelioma suele presentarse entre los 50-70 años, pero en contra de este diagnóstico, si bien en los estudios por imágenes se observa derrame pleural, éste es bilateral y no hay engrosamiento de las hojas pleurales. Por último, los sarcomas son tumores mesenquimáticos raros (representan <2% de las masas mediastinales) y predominan en la población pediátrica. Por lo que considero que estas neoplasias son diagnósticos alejados en el paciente en discusión.
Cómo continuar el estudio del paciente? El diagnóstico histológico es fundamental para poder determinar la etiología subyacente del SVCS y poder aplicar así el tratamiento adecuado. Técnicas mínimamente invasivas son utilizadas habitualmente con este fin como son la citología de esputo, de líquido pleural y biopsia de adenopatías periféricas (por ej: supraclaviculares, inguinales o axilares) pudiendo obtenerse un diagnóstico hasta en 2/3 de los casos. Nuestro paciente no presenta adenopatías accesibles para la realización de biopsia por escisión.
La citología de esputo es un método diagnóstico inocuo y ha demostrado presentar marcada sensibilidad (74%) y elevada correlación histológica. La rentabilidad diagnóstica se incrementa con un mayor número de muestras (la obtención de tres muestras eleva la sensibilidad diagnóstica: 74% frente a 58%) y ante la presencia de masas pulmonares centrales. El paciente en consideración no presenta expectoración, por lo que propongo la realización de esputo inducido.
En el hospital universitario La Paz de la ciudad de Madrid se realizó un trabajo destinado a evaluar la utilidad de la citología de esputo inducido para el estudio de masas pulmonares en ancianos. Este incluyó 23 pacientes mayores de 75 años, todos tabaquistas o ex tabaquistas con masas pulmonares mayores de 3 cm. Se recogieron muestras satisfactorias mediante inducción de esputo en 19 enfermos (83%), resultando positivo el examen citológico para malignidad en 14 casos (sensibilidad 74%) y negativa en 5. Se realizó FBC a todos los pacientes, resultando diagnóstica en 21 pacientes (sensiblidad: 91%).
El derrame pleural es común en los pacientes con SVCS, presentándose hasta en 2/3 mismos. Si bien el rédito diagnóstico es sólo del 50%, de cualquier modo se considera conveniente la realización de toracocentesis y citología del líquido pleural porque es un procedimiento sencillo. Nuestro paciente presenta derrame pleural bilateral que podría ser compatible con un cuadro de sobrecarga hídrica, en este contexto el citofisicoquímico del líquido nos ayudaría a diferenciar si nos encontramos ante un trasudado o un exudado. A pesar de esto, el derrame no parece ser de una cuantía significativa suficiente para la realización de este procedimiento.
Ante la presencia de derrame pericárdico moderado se podría plantear la realización de una pericardiocentesis con toma de muestra para biopsia, pero es sabido que presenta muy bajo rédito diagnóstico (incluso <40%), por lo que no la realizaría a menos que fuera necesario el procedimiento con fines terapéuticos. Parámetros como las proteínas, LDH, glucosa y recuento de glóbulos rojos y leucocitos no son fiables para distinguir entre trasudado y exudado. Además creo que en el contexto del paciente, el mismo también podría encontrarse asociado a la diálisis.
Si con los estudios previamente mencionados no se arriba a un diagnóstico histológico o estos no pueden ser realizados, en el siguiente nivel nos encontramos con los estudios endoscópicos, como son la broncoscopía y la mediastinoscopía.
La broncoscopía diagnóstica no sólo permite la toma directa de muestra para biopsia, sino que con la realización de cepillado bronquial protegido y lavado broncoalveolar tiende a incrementar su rédito diagnóstico, alcanzando entre 50-70%. Es considerada actualmente como la mejor alternativa a la mediastinoscopía.
Podría realizarse también una punción transtorácica guiada bajo TC. El inconveniente de esta metodología es que puede no obtenerse suficiente material histológico para abordar al diagnóstico. De todos modos, el paciente en discusión presenta una lesión peribronquial central, por lo que creo que sería de mayor utilidad la broncoscopía y en el caso de no ser suficiente, la realización posterior de una mediastinoscopía.
Le mediastinoscopía fue introducida por primera vez en 1959 por Carlens con el fin de evitar la realización de toracotomías de forma innecesaria para estadificación ganglionar mediastínica.
Durante muchos años se ha afirmado que la mediastinoscopía en pacientes con SVCS era un procedimiento inapropiado con alta morbimortalidad debido al riesgo de sangrado por la gran distensión venosa presente y el pobre pronóstico que presentaban los pacientes con SVCS de etiología maligna. Sin embargo, en este cuadro se considera la técnica más confiable para la obtención de un rápido diagnóstico histológico y no se ha hallado evidencia en la literatura que justifique esta afirmación.
De hecho, hay 2 estudios realizados en centros experimentados en cirugía torácica que intentan demostrar que la mediastinoscopía es un procedimiento con alto rédito diagnóstico y baja frecuencia de complicaciones serias.
El primero de los estudios fue realizado entre los años 1974-1977 con un total de 80 pacientes con diagnóstico de SVCS; arribándose al diagnóstico en la totalidad de los mismos. 5 pacientes presentaron un sangrado importante, pero sólo uno requirió la realización de una esternotomía.
El segundo estudio fue realizado entre 1982-1993 e incluyó 34 pacientes con SVCS en los cuales no se había arribado al diagnóstico primario tras la realización de procedimientos menos invasivos. Se obtuvo diagnóstico histológico en todos los casos. Uno de los pacientes presentó sangrado arterial de la innominada, requiriendo esternotomía para cohibir el mismo.
La mediastinoscopía es un procedimiento adecuado para la obtención de diagnóstico histológico en el SVCS cuando otras técnicas han fallado y sino se puede obtener una muestra representativa, se puede proceder en el mismo acto quirúrgico a la realización de una mediastinotomía anterior.
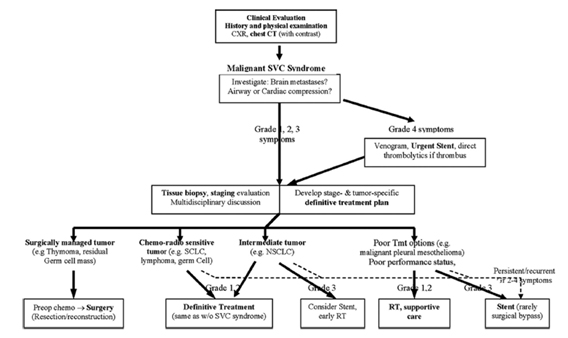
Otro interrogante que me planteo es si este paciente requiere la colocación de un stent endovascular. Tradicionalmente, el SVCS ha sido considerado una emergencia oncológica. Sin embargo, trabajos recientes postulan que, en general, el curso es relativamente benigno. No ha sido bien definido que pacientes requieren terapéutica urgente y en quienes estaría indicado únicamente el tratamiento específico de la patología de base y no existen guías ni estudios randomizados que se hayan ocupado de este tema
Las conductas deben guiarse por la severidad de los síntomas y la neoplasia asociada como a la respuesta esperada al tratamiento. Por ejemplo, en pacientes con linfoma, cáncer de pulmón de células pequeñas o tumores germinales la respuesta clínica a la quimioterapia sistémica típicamente es rápida. En la mayoría de pacientes con cáncer de pulmón de células no pequeñas, el alivio de los síntomas del SVCS resulta del tratamiento de la neoplasia, pero el grado y rapidez de respuesta es menor.
En cuanto al tratamiento médico (cabecera sobreelevada, oxigenoterapia y diuréticos) no hay estudios que documenten su efectividad. Los glucocorticoides, a pesar de que son ampliamente utilizados sólo son útiles en los pacientes con linfoma y timoma. La radioterapia es útil, una vez realizado el diagnóstico histológico, ya que la mayoría de tumores que se asocian al SVCS son radiosensibles. La mejoría sintomática se presenta a las 72 hs de realizada.
La colocación de un stent endovascular puede realizarse incluso antes de que el diagnóstico histológico se encuentre disponible, por lo que es un procedimiento útil en pacientes con síntomas severos. También debería considerarse en los pacientes con diagnóstico de mesotelioma que no suelen responder bien a la quimioterapia y radioterapia.
Una forma de determinar la severidad del cuadro es mediante la clasificación de Stanford, la cual se basa en el grado de estenosis que presenta el paciente. El tipo I se refiere a una obstrucción leve, < 90%, el tipo II es una obstrucción severa con estenosis del 90-100%, el tipo III presenta obstrucción completa y flujo importante a través de colaterales sin compromiso de venas mamaria y epigástrica, lo cual se observa en el tipo IV.
La severidad de los síntomas es importante para determinar la urgencia de la intervención, por lo que el departamento de Cirugía Torácica de la Universidad de Yale propuso una clasificación del SVCS según los síntomas y de acuerdo a esto, un algoritmo terapéutico.

Cuando los síntomas amenazan la vida (grado 4) está indicada la intervención urgente con colocación de un stent endovascular. Este procedimiento también debiera realizarse en pacientes con síntomas grado 3 que no toleran el tratamiento de su neoplasia o aquellos con síntomas persistentes o recurrentes luego del tratamiento. Los pacientes con síntomas grado 1 y 2 y la mayoría con grado 3 deberían someterse a estudios diagnósticos y de estadificación para definir el tipo de tumor y el grado de compromiso.
Otro interrogante a abordar es si existe relación entre el diagnóstico previo de nefropatía membranosa que presenta el paciente y los posibles diagnósticos que se plantean ante el cuadro actual. Si bien la asociación entre nefropatía membranosa y cáncer es frecuentemente mencionada hay pocos estudios que avalen la misma. El principal cuestionamiento para esta relación es que los tumores que más frecuentemente se asocian predominan en mayores de 50 años que es la edad de presentación de la nefropatía membranosa.
Entre quienes defienden dicha asociación se postula que entre 5-20% de los pacientes con NM presentan alguna neoplasia asociada, principalmente tumores sólidos (cáncer de pulmón, riñón, mama o tracto gastrointestinal) y menos frecuentemente alguna neoplasia oncohematológica como LLC. Un posible mecanismo para esta asociación sería el depósito de antígenos tumorales a nivel glomerular con el posterior depósito de anticuerpos y activación del complemento.
En cuanto a la relación temporal el desarrollo de tumores ha sido descripto hasta 5 años después del diagnóstico de GN (recordemos que nuestro paciente ya lleva 7 años desde el diagnóstico del síndrome nefrótico).
Traigo a colación 2 estudios que intentan determinar la relación entre el diagnóstico de nefropatía membranosa y el desarrollo de una neoplasia maligna. El primero es un estudio de cohorte que abarcó 240 pacientes con NM, de estos 24 tenían diagnóstico de cáncer al momento de la biopsia renal o lo presentaron dentro del año. Se observó un incremento en la frecuencia de malignidad con la edad. Intentando determinar que pacientes presentarían luego del diagnóstico una neoplasia maligna, se observó que en las biopsias renales de aquellos pacientes con cáncer o quienes lo presentaron posteriormente había mayor número de células inflamatorias (8 por glomérulo) y además se observó disminución de la proteinuria en aquellos pacientes que presentaron remisión del cáncer.
El segundo estudio es retrospectivo, abarca 107 pacientes adultos con GNF membranosa, de los cuales 20 presentaban una causa secundaria no maligna, 9 (10.3%) tenían o desarrollaron posteriormente una neoplasia y el resto se clasificó como idiopático. De los pacientes con diagnóstico de cáncer se pudo realizar seguimiento en 7 de ellos: 2 presentaron remisión completa de la proteinuria asociado al tratamiento oncológico, 1 desarrolló enfermedad renal terminal y 2 presentaron proteinuria persistente asociado a remisión del tumor o afección metastásica.
En los últimos años se han comenzado a desarrollar estudios con el fin de poder diferenciar los casos idiopáticos de NM de aquellos asociados a malignidad. La ausencia de depósitos glomerulares de IgG4 determinado por inmunohistoquímica sugeriría un proceso neoplásico asociado a la nefropatía. Sin embargo, estas técnicas no se encuentran disponibles en la mayoría de hospitales. Como otras herramientas de utilidad para la diferenciación entre NM asociada a malignidad e idiopática son la mayor edad, niveles más bajos de albúmina y más altos de PCR en la primera.
En resumen nos encontramos ante un paciente IRC por una nefropatía membranosa que se presenta con un síndrome de vena cava superior. Considero como probables etiologías, principalmente las neoplasias, entre ellas el cáncer de pulmón y el linfoma y entre las causas benignas encontramos a la mediastinisitis fibrosante y las infecciones como la TBC. Como metodología diagnóstica propongo la realización de citología de esputo seguido de una broncofibroscopía con BAL y cepillado endobronquial y de no arribarse a una metodología diagnóstica considerar la mediastinoscopía. Por la clínica y el grado de obstrucción que presenta el paciente en discusión no considero necesaria actualmente la colocación de un stent endovascular. Es de fundamental importancia arribar a un diagnóstico etiológico para poder aplicar un tratamiento específico.
Bibliografía
- Wilson L, Detterbeck F. Superior Vena Cava Syndrome with Malignant Causes. N Engl J Med 2007;356:1862-9.
- Lepper P, Ott S et al. Superior Vena Cava Syndrome in Thoracic Malignancies. Respir Care 2011;56(5):653– 666.
- Fijołek J, Wiatr E et al. Fibrosing mediastinitis as an untypical complication of tuberculosis. Pol Arch Med Wewn. 2009; 119 (11): 752-755
- Rossi S, McAdams H et al. Fibrosing Mediastinitis. RadioGraphics 2001; 21:737-757
- Jahangiri M, Goldstraw P. The Role of Mediastinoscopy in Superior Vena Caval Obstruction. Ann Thorac Surg 1995;59:453-5.
- Mineo T, Ambrogi V et al. Mediastinoscopy in Superior Vena Cava Obstruction: Analysis of 80 Consecutive Patients. Ann Thorac Surg 1999;68:223– 6.
- Yu J, MD,Wilson L. Superior Vena Cava Syndrome—A Proposed Classification System and Algorithm for Management. Journal of Thoracic Oncology - Volume 3, Number 8, August 2008
- Mora-Mora M, Rangel-Hidalgo G et al. Membranous glomerulonephritis secondary to neoplasia. Different forms of presentation. Nefrologia 2012;32(4):547-8
- Burstein DM, Korbet SM et al. Membranous glomerulonephritis and malignancy. Am J Kidney Dis. 1993 Jul;22(1):5-10.
- Lefaucheur C, Stengel B et al. Membranous nephropathy and cancer: Epidemiologic evidence and determinants of highrisk cancer association. Kidney Int 2006;70:1510-7.
- Qu Z, Liu G et al. Absence of glomerular IgG4 deposition in patients with membranous nephropathy may indicate malignancy. Nephrol Dial Transplant. 2012 May;27(5):1931-7.
|
|
|
Discusión |
|
La discusión de este seminario
corresponde al 13 de Diciembre de 2012, a
cargo de Dra. Gisela Goldberg |
|
| |
|
|
| |
|
|
|
|
|