|
Discusión del
caso clínico
Dra. Bellagamba, Claudia
Nos encontramos ante un paciente de 58 años que presenta como antecedentes de jerarquía dos accidentes cerebrovasculares, cirugía de recambio valvular por estenosis aórtica severa sintomática que presenta como complicaciones en el posoperatorio inmediato fibrilación auricular, taponamiento cardiaco y mediastinitis requiriendo reintervención quirúrgica precoz, e ingresa actualmente por síndrome febril, presentando durante la internación un nuevo foco neurológico.
Como objetivos de esta discusión planteo:
- Analizar la mediastinitis en cuanto a su manifestación, diagnóstico y tratamiento.
- Evaluar la causa más probable del síndrome febril actual.
- Valorar el foco neurológico que presenta el paciente y cuáles serían las posibles explicaciones fisiopatológicas.
- Esbozar un esquema de tratamiento antibiótico que se ajuste a este caso en particular.
- Plantear como interrogante final la reinstauración del tratamiento anticoagulante.
En cuanto al primer aspecto, la mediastinitis aguda como sabemos es la inflamación del tejido conectivo del mediastino, tratándose de una afección grave. Previo al desarrollo de la cirugía cardiovascular moderna la mayoría de los casos eran debidos a la perforación esofágica o a infecciones odontógenas o retrofaringeas. Actualmente cobra gran relevancia la cirugía cardiovascular y, dentro de ella, la cirugía de recambio valvular y las cirugías de revascularización miocárdica. La incidencia actual es del 0.4 al 5%, siendo en la mayoría de los centros cercana al 1-2%.
Los pacientes presentan fiebre, taquicardia, dolor de pecho, inestabilidad esternal o secreción purulenta mediastinal; otros hallazgos locales son la crepitación y el edema en la pared torácica y el signo de Hamman's (sonido de crepitación sincrónico con el latido cardíaco, detectado a la auscultación). Fiebre y bacteriemia pueden ser los primeros signos, por lo cual la mediastinitis debe siempre ser considerada ante estos hallazgos.
La CDC establece los siguientes criterios diagnósticos (1), pudiendo definir mediastinitis cuando el paciente cuenta con al menos una de las siguientes:
- Presenta aislamiento en cultivos obtenidos de tejido mediastinal o fluido obtenido durante un procedimiento quirúrgico.
- Evidencia macroscópica o histopatológica de infección mediastinal evaluada durante cirugía
- Presenta al menos uno de los siguientes: fiebre, dolor de pecho (en ausencia de otra causa) o inestabilidad esternal y al menos uno de los siguientes: descarga purulenta del área mediastinal, hemocultivos positivos o cultivo de secreción mediastinal con aislamiento de gérmenes o ensanchamiento mediastinal en imágenes.
Otras definiciones (2) en distintos estudios mencionan:
- Diastasis de la sutura esternal acompañada de secreción macroscópicamente purulenta.
- Burbujeo sincrónico con la respiración de secreción purulenta a través de la herida.
- Colección retroesternal detectada mediante la cirugía y;
- Secreción purulenta, inestabilidad esternal y dolor a nivel de la herida.
El paciente presentó en la internación previa una mediastinitis, dado que se constató fiebre, hemocultivos y cultivo de secreción mediastinal positivos,inestabilidad esternal y descarga purulenta del área mediastinal, con lo cual cumple varios criterios.
Continuando con la patología podemos evaluar posibles factores de riesgo para el desarrollo de la misma, tanto prequirúrgicos como intra y postoperatorios. Cabe mencionar (10,11,12):
- Diabetes o hiperglicemia perioperatoria; Obesidad; Enfermedad arterial periférica; Tabaquismo; Utilización de ambas mamarias internas en CRM; Cirugía prolongada, mayor a 5 hs; Reintervenciones precoces (dentro de los 4 días), por ejemplo por sangrado; Estadía prolongada en unidad de cuidados críticos en POP.
En el caso de nuestro paciente sabemos que el tiempo de permanencia en UCI (RCV) fue de 9 días hasta el diagnóstico de mediastinitis y 15 días totales, la permanencia del catéter de Swan Ganz fue de sólo 24 hs y presentó complicaciones posoperatorias que requirieron su reintervención a los 5 días del recambio valvular (taponamiento pericárdico).
La mayoría de los pacientes tienen infecciones monomicrobianas, aproximadamente en el 80 % de los casos en la mayoría de las series. Dentro de los gérmenes más frecuentemente aislados (4,5) encontramos SAMS 45 % SAMR 16 % BGN 17 % SCN 13 % estreptococo 5 %. Con menor frecuencia la mediastinitis posoperatoria se debe a gérmenes tales como Legionella, Mycoplasma hominis, Nocardia, Mycobacterium tuberculosis u hongos.
En varios estudios, entre ellos el publicado en The Journal of Thoracic Cardiovascular Surgery (3), se ha relacionado el aislamiento de SAMS con la presencia de cultivo de hisopado nasal positivo prequirúrgico positivo para dicho germen y SAMR con la transmisión nosocomial; en este estudio en 17 casos de mediastinitis 9 se debieron a SAMS y 7 de ellos presentaron hisopado positivo previo mientras que en los 8 casos asociados a SAMR no se obtuvo dicho germen en hisopado previo. Resulta interesante este trabajo dado que induce a pensar en la utilidad del hisopado nasal a fin de realizar la búsqueda activa de la colonización por Estafilococo, actividad poco difundida en nuestro medio y de gran utilidad, por ejemplo en el caso de nuestro paciente.
En cuanto al diagnóstico, este es en general clínico, aunque existen datos que pueden apoyar el mismo; así la mayoría de los pacientes presentan leucocitosis, hallazgo inespecífico. El ensanchamiento mediastinal en radiografía (Rx), característico de la mediastinitis no quirúrgica, es mucho menos frecuente en la mediastinitis posoperatoria. Otros hallazgos radiológicos, si bien poco frecuentes, son niveles aire-líquido en mediastino o tejido subcutáneo del tórax y el aire mediastinal en la Rx con incidencia lateral. En cuanto a la tomografía es útil en el diagnóstico si demuestra fluido o colecciones mediastinales o neumomediastino, siendo otros hallazgos menos específicos y de menos valor diagnóstico. No obstante cuenta con un valor importante en el seguimiento de la evolución de estos pacientes. La TC tiene una sensibilidad del 100% pero una especificidad del 33 % cuando se realiza antes del día 14 posoperatorio; pero la sensibilidad y especificidad rondan el 100 % cuando se realiza posteriormente. (6,7)
Los hallazgos tomográficos específicos de mediastinitis no tienen la frecuencia necesaria para que puedan ser tomados como única herramienta de diagnóstico en esta patología que dependerá también de la clínica y de la bacteriología, pero es un método diagnóstico insustituible para la evaluación imagenológica y para su tratamiento y control evolutivo (32).
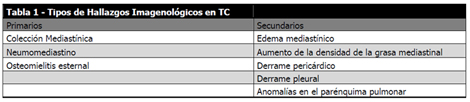
Otro aspecto relevante en el diagnóstico lo constituyen los cultivos microbiológicos: los hemocultivos presentan una alta tasa de positividad en las mediastinitis, existiendo reportes de hasta en 90%, lo cual es más significativo en aquellos casos asociados a Staphylococcus aureus. Los cultivos de los cables de estimulación epicárdica pueden presentar utilidad en la mediastinitis de comienzo precoz, alcanzando una sensibilidad del 75 % y una especificidad del 83% en algunos reportes (8,9)
Volviendo a nuestro paciente recordemos la presencia de manifestaciones clínicas compatibles más hemocultivos y cultivos de secreción mediastinal positivos.
El tratamiento de las mediastinitis requiere una combinación de procedimientos quirúrgicos y antimicrobianos. Dentro del primer grupo se recomienda la reapertura de la esternotomía, lavado mecánico, retiro de material y tejido infectado o necrótico y eventual colocación del sistema de VAC. Cuando no se encuentra tejido óseo viable, es posible disecar colgajos de ambos músculos pectorales para avance y traslape de los mismos en la porción media de la cara anterior de tórax, así como de acuerdo a las características anatómicas, puede realizarse ascenso de epiplón (omentoplastía) (14).
En segundo lugar, los antibióticos deben iniciarse tan pronto como se realice o sospeche el diagnóstico, previa toma de cultivos. El tratamiento empírico inicial debe cubrir tanto cocos gram (+) como bacilos gram (-), por lo que suele emplearse vancomicina y una cefalosporina de tercera generación o piperacilina tazobactam, pero se debe ajustar a los aislamientos tan pronto sea posible.
Una vez instaurado el tratamiento el tiempo que debe durar es controvertido; algunos autores mencionan la posibilidad de tratamiento durante 2 o 3 semanas asociado a la remoción del esternón, reemplazado por una “solapa esternal”. En caso de que esto no sea posible o exista hueso residual se recomienda terapia antimicrobiana durante 4 a 6 semanas.
La mortalidad es de entre el 12 y 50 %, y se mantiene hasta 1 o 2 años de la cirugía (8% en pacientes que presentaron mediastinitis Vs 2 % en aquellos que no presentaron dicha complicación), mientras que otros estudios sugieren un aumento del riesgo de hasta 10 años. (10, 11, 12, 13)
Predictores independientes de riesgo serían:
- Retraso mayor a 3 días en el cierre esternal luego del debridamiento; Edad > 65 años; Permanencia en UCI antes de la toilette quirúrgica; Creatinina sérica >2 mg/dl; Infección por SAMR.
Resumiendo en asociación al caso discutido creo que el diagnóstico de mediatinitis fue acertado, presentando aislamiento de SAMS y luego realizando debridamiento, omentoplastia, colocación de drenaje mediastinal y terapéutica antimicrobiana ajustada a dicho gérmen según antibiograma durante 6 semanas, todo lo cual impresiona haber sido correcto. Pudiera haber sido prudente la realización de una TC de tórax a fin de evaluar la suspensión del tratamiento y el seguimiento de reactantes de fase aguda, así como el ya mencionado hisopado nasal prequirúrgico.
En segundo término creo relevante analizar el síndrome febril por el que reingresa el paciente a nuestra institución. ¿Podemos considerar encontrarnos nuevamente ante un caso de mediastinitis? El paciente presenta fiebre y hemocultivos positivos, asociado a dehiscencia de herida de esternotomia previa, datos que apoyarían ese diagnóstico. En contra de este aspecto el paciente no refiere dolor a nivel esternal, no presenta secreción purulenta, inestabilidad esternal, crepitación ni edema de la pared torácica y en la TC presenta reticulación de la grasa sin hallazgo de neumomediastino, ni fluido o colecciones mediastinales, por lo que creo que si bien es un diagnóstico posible no es el más probable en este caso.
En segundo lugar podríamos plantear como causa una probable endocarditis infecciosa.
El paciente cumple con un criterio mayor: hemocultivos positivos y 3 menores: fiebre, cardiopatía predisponente y fenómenos embólicos. ¿Nos encontramos en la internación previa ante un cuadro de mediastinitis más endocarditis infecciosa? Cumplía en dicha oportunidad un criterio mayor y 2 menores, siendo el diagnóstico posible y sólo se realizó en esta oportunidad un ecocardiograma transtorácico, por lo que creo que hubiera sido de gran utilidad la realización de un ecocardiograma transesofágico, el cual presenta mayor sensibilidad.
La endocarditis sobre válvula protésica se desarrolla en 1 a 4% de los pacientes sometidos a cirugía de recambio valvular (CRV) durante el primer año luego de la cirugía, y luego aproximadamente 1% por año. El tipo de válvula protésica no tendría impacto en el desarrollo posterior de endocarditis (15,16).
En el caso de nuestro paciente nos encontraríamos frente a un caso de infección temprana, las cuales se asocian a contaminación intraoperatoria o vía hematógena durante los primeros días siguientes a la cirugía. Estos patógenos tienen acceso directo a la interfase anillo- prótesis y al tejido perivalvular dado que aun no ha sido endotelizado el sitio de implante. El riesgo de desarrollar endocarditis es mayor durante los primeros 3 meses luego de la cirugía, se mantiene alto durante 6 meses y luego disminuye gradualmente durante el primer año (17-22)
Asimismo resulta de interés considerar el caso del paciente como endocarditis asociada al cuidado de salud, la cual se define como aquella diagnosticada dentro de las primeras 48 horas de la internación del paciente, en un individuo externado que continúa en contacto con el sistema de salud:
- Tratamiento endovenoso, cuidado de heridas, o la atención de enfermería especializada en el hogar de los 30 días previos; residencia en un hogar de ancianos u otro centro de atención; hospitalización en un hospital de agudos durante dos o más días dentro de los últimos 90 días; asistencia a un hospital o clínica de hemodiálisis dentro de los 30 días previos.
Las manifestaciones clínicas son similares a la endocarditis de válvula nativa pudiendo hallar nuevo soplo, falla cardíaca, cambios electrocardiográficos. La incidencia clínica de embolia arterial es del 40 % y las complicaciones a nivel del SNC ocurren en 20 a 40 % de los pacientes incluyendo isquemia por embolismo o hemorragias. Debe realizarse una exploración clínica minuciosa a fin de detectar lesiones de Janeway, nódulos de Osler, hemorragias retinianas de Roth, hemorragias conjuntvales.
En ausencia de tratamiento antibiótico previo, los hemocultivos son positivos en el 90 % de los pacientes con endocarditis de válvula protésica y el valor diagnóstico de los mismos aumenta cuanto mayor es la positividad encontrada.
En cuanto al ecocardiograma tiene demostrada utilidad en el diagnóstico de endocarditis. Se sugiere realizar ambos en el diagnóstico y seguimiento de la endocarditis sobre válvula protésica (25). Podría sin embargo en este caso sugerirse iniciar con un ETE debido a que se trata de válvula protésica aórtica y que el paciente presenta bacteriemia a Staphylococcus aureus. Un estudio prospectivo comparó el ecocardiograma transtorácico (ETT) y el ecocardiograma transesofágico (ETE) en 114 casos de sospecha de endocarditis (34 sobre válvula protésica y 80 sobre válvula nativa) El resultado de ambos fue concordante en el 55 % de los casos pero el ETE llevó a una reclasificación en el 34 % de los pacientes con válvula protésica y en 11% de los pacientes con válvula nativa, siendo 22 pacientes clasificados como endocarditis definitiva basado en el resultado del ETE (10 pacientes con válvula protésica) (24). El ETT resulta superior en la obtención de imágenes de la superficie ventricular de las prótesis, mientras que las superficies auriculares de mitral y tricúspide y la superficie aórtica y el tracto de salida de la prótesis aórtica son mejor visualizados mediante el ETE. Asimismo el ETE es superior en la evaluación de complicaciones: abscesos, fístulas, rotura de válvula. El valor predictivo negativo de la utilización de ambos métodos en la evaluación de una paciente con sospecha de EI sobre válvula protésica es cercano al 90 % Sin embargo si la sospecha es alta el ecocardiograma debe ser repetido en una ocasión posterior.
Como sabemos existen múltiples complicaciones a considerar ante un caso de endocarditis infecciosa. Podríamos clasificarlas en:
- Cardíacas: 66% falla cardíaca, insuficiencia valvular, IAM, absceso perivalvular, arritmias y cambios ECG, pericarditis, fístulas, aneurismas o pseudoaneurismas
- Sépticas: pudiendo presentarse como embolias sépticas en riñones, bazo, SNC, partes blandas (absceso del psoas) Hay una fuerte asociación de EI y abscesos esplénicos, pueden ser asintomáticos y hallarse ante la persistencia de registros febriles a pesar de la mejoría a nivel cardíaco; generalmente se requiere la esplenectomía.
- Embólicas: (complicación frecuente de la EI) 13 al 44 % ACV, Amaurosis, isquemia de extremidades o gangrena, dolor por infarto visceral (esplénico o renal), émbolos pulmonares, IAM.
- Neurológicas: ACV embólico o hemorrágico, encefalopatía, meningoencefalitis, meningitis, absceso cerebral.
- Musculoesqueléticas: Osteomielitis vertebral, espondilodiscitis, artritis séptica (con mayor frecuencia asociada a S. aureus.
- Renales: infarto renal, nefritis intersticial (asociada al tto), glomerulonefritis, abscesos renales, IRA
- Asociadas al tratamiento: Ototoxicidad o nefrotoxicidad por aminoglucósidos, bacteriemias secundarias a accesos vasculares, flebitis, fiebre por drogas, manifestaciones hemorrágicas, secundarias a anticoagulación, mediastinitis posquirúrgica.
Asimismo podemos clasificarlas según su fisiopatología en:
- Embólicas, invasión local, infección diseminada, daño inmunomediado.
En relación a las complicaciones embólicas y al respecto de nuestro paciente, ocurren en 22 a 50 % de las EI (28,29), siendo las más frecuentes en SNC, extremidades y eje esplenoportal.
Centrándonos en el caso de nuestro paciente presenta como complicaciones las embólicas a nivel de bazo y SNC.
Las Guías de Práctica Clínica de la Sociedad Española de Cardiología en Endocarditis señalan que la existencia de embolias de repetición, con persistencia de imágenes de vegetaciones, puede hacer aconsejable la cirugía (30), aun en ausencia de otra indicación quirúrgica como serían la insuficiencia cardíaca o los signos de infección persistente. La necesidad de cirugía extracardíaca ha sido excepcional. La esplenectomía sólo es necesaria cuando se documenta una gran desestructuración parenquimatosa, por tratarse de un potencial foco de sepsis y por el riesgo de rotura del órgano. En estos casos se aconseja un abordaje secuencial, con una esplenectomía laparoscópica en un primer tiempo, seguida del reemplazo valvular (31). También es posible realizar el drenaje del absceso guiado por imagen
La morbilidad asociada fue mayor en los episodios con embolias. Estos pacientes presentaron durante su evolución con más frecuencia otras embolias (principalmente, en el sistema nervioso central), signos de infección persistente, shock séptico e insuficiencia renal.
En cuanto a las complicaciones sintomáticas en SNC ocurren en el 35 % de los casos, mientras que las complicaciones silentes se observan en el 80 %. El ACV isquémico se presenta el 4 al 14 % de los pacientes con EI. Se debe pensar en esta complicación en todo paciente con EI que desarrolla un foco neurológico y viceversa se debe buscar activamente EI en aquellos pacientes jóvenes que desarrollan un ACV, o presentan manifestaciones isquémicas de 2 órganos a distancia. La enfermedad cerebrovascular isquémica constituye la principal complicación neurológica descrita, mientras que los eventos hemorrágicos, si bien sólo representan 2% a 8% de las complicaciones neurológicas, son los principales responsables de la carga mórbida en estos pacientes. Otras complicaciones que se describen con frecuencia corresponden a las neuroinfecciones producto del embolismo séptico (33,34,35)
Podemos clasificar las complicaciones en SNC en hemorrágicas (hemorragia intraparenquimatosa, hematoma subdural o epidural y hemorragia subaracnoidea), isquémicas (por trombosis o embolismo) a infecciosas (meningitis, meningoencefalitis, abscesos, embolias sépticas).
En el paciente analizado parecen más probables las causas embólicas y las embolias sépticas en SNC.
En cuanto al tratamiento antibiótico, ¿Cuál sería el adecuado en este paciente? La mayoría de las guías coinciden en realizar tratamiento antibiótico empírico inicial cubriendo los gérmenes más frecuentes y virulentos, entre ellos el SAMR y posteriormente ajustar antibioticoterapia al resultado de los cultivos, asimismo se propone en el tratamiento de EI de válvula protésica con aislamiento SAMS (con distintos niveles de evidencia) la realización de esquema asociando Cefalosporina de 1º generación con Rifampicina y aminoglucósido durante 2 semanas. Como interrogante surge entonces la posibilidad de realizar Vancomicina cubriendo este aislamiento en reemplazo de las Cefalosporinas de 1 º generación. La bibliografía al respecto propone varios argumentos en contra de esta medida. A modo de ejemplo en el estudio: Use of Vancomycin or First-Generation Cephalosporins for the Treatment of Hemodialysis- Dependent Patients with Methicillin-Susceptible Staphylococcus aureus Bacteremia, realizado en el Centro Universitario Duke (Durham, NC) durante el período de 6 años en pacientes con tratamiento hemodialítico y bacteriemia a SAMS, se identificaron 140 pacientes de los cuales 17 fueron excluidos (77 realizaron tto con Vancomicina y 46 con Cefazolina; se demostró que el uso de Vancomicina se asocio a mayor tasa de fracaso del tratamiento a las 12 semanas, y el uso de vancomicina fue identificado como factor independiente de riesgo para fallas en el tratamiento; los pacientes que recibieron cefazolina obtuvieron resultados superiores (36).
Asimismo en el estudio Comparative effectiveness of nafcillin or cefazolin versus vancomycin in methicillin-susceptible Staphylococcus aureus bacteremia, retrospective, realizado en la Universidad de Maryland, se estudiaron 326 pacientes con bacteriemia a SAMS Se excluyeron 31 pacientes identificándose 267 casos; 14 % recibieron nafcilina o cefazolina 51 % recibieron alguna de las mismas más vancomicina y 35 % realizaron sólo vancomicina ; en 40 pacientes se realizó el diagnóstico de endocarditis siendo positivo el ecocardiograma en 60 % los pacientes que recibieron cefazolina presentaron menos enfermedad renal y requerimiento de hemodiálisis, presentaron menos frecuentemente accesos venosos centrales, presentando asimismo menor severidad de la enfermedad y comorbilidades. La mortalidad a los 30 días de la hospitalización fue del 3 % en los pacientes que recibieron cefazolina, 7 % en aquellos que recibieron cefazolina en asociación con vancomicina y 20 % en aquellos que sólo recibieron vancomicina. Se demostró también el beneficio del switch precoz a cefazolina al obtener aislamiento de SAMS; con lo cual el inicio de la terapéutica empírica con vancomicina parecería razonable si luego de rotara precozmente según antibiograma. La guía de la Sociedad Americana para las enfermedades infecciosas. The recent clinical practice guidelines by the Infectious, para el tratamiento de SAMR establece que la Vancomicina es claramente inferior a betalactámicos en el tratamiento de bacteriemia y endocarditis infecciosa por SAMS (37) Por último creo interesante hacer mención a un aspecto controversial, tratado en el articulo Reduced Vancomycin Susceptibility Found in Methicillin-Resistant and Methicillin-Sensitive Staphylococcus aureus Clinical Isolates in Northeast China, publicado en 2013, el cual hace referencia al aumento en la incidencia de SAMS y SAMR con sensibilidad intermedia a vancomicina y las posibles alternativas terapéuticas (39). Este estudio tendría importante implicancia en este caso dado que se plantea en caso de bacteriemia a SAMS, iniciar el tratamiento con cefalosporinas de primera generación, mientras que, de no poder realizar cefalosporinas de 1º generación la CIM a vancomicina trazaría la decisión: si la CIM es alta el segundo escalón terapéutico lo constituyen daptomicina, linezolid, y tigeciclina, mientras que si la CIM es baja la segunda opción podría representarla la vancomicina.
Por lo expuesto considero que en nuestro paciente fue adecuado el tratamiento con cefalosporinas de 1º generación durante la internación por mediastinitis, y actualmente creo que sería adecuado realizar como tratamiento de la EI con cefalosporinas de 1º generación, asociadas a rifampicina y gentamicina, teniendo en consideración que dado que el paciente inició tratamiento con vancomicina y rifampicina tal vez sería posible continuar con dicho esquema, sin estar demostrado fehacientemente el beneficio que aportaría este último esquema en el tratamiento de las complicaciones a nivel del SNC que presenta el paciente en ausencia de meningitis.
En relación al tratamiento quirúrgico, las indicaciones de realización del mismo la constituirían la falla cardíaca, fiebre persistente, a pesar del tratamiento antibiótico, embolias sistémicas a repetición, anormalidades electrocardiográficas. Tengamos en cuenta que la enfermedad invasiva es más frecuente en la endocarditis de válvula protésica, en especial dentro de los 12 meses de la cirugía que involucra prótesis aórtica, caso en el que se encontraría nuestro paciente.
American College of Cardiology/American Heart Association (ACC/AHA) Guías de 2006 (40) recomiendan cirugía de EI sobre válvula protésica en: ICC, dehiscencia valvular, progresión de insuficiencia valvular u obstrucción y complicaciones locales, tales como abscesos, así como también ante los signos persistentes de infección o embolias sistémicas a repetición.
Nuestro paciente presenta una endocarditis sobre válvula protésica precoz estafilocóccica, por lo cual tiene al menos indicación de cirugía valvular electiva con nivel de evidencia B, una vez realizado el ecocardiograma, creo que éste aportaría información valiosa, con la posible necesidad de cirugía de urgencia.
Predictores independientes de mortalidad incluyen: comorbilidades, EIVP precoz (<60 días), ICC severa, infección estafilocóccica, dehiscencia de la prótesis.
Como último interrogante ¿Qué conducta se debe tomar en relación a la anticoagulación?
No existe fuerte evidencia en relación a este aspecto y en la mayoría de los casos se trata de opinión de expertos.
Existe consenso en el requerimiento de anticoagulación en pacientes con prótesis valvular; aquellos pacientes portadores de válvulas protésicas que desarrollan EI requieren anticoagulación y en general hay consenso acerca de la implementación de la misma. Contrariamente no existe consenso acerca del uso de anticoagulación en pacientes con válvula protésica, EI y stroke. En los pacientes que desarrollan clínica compatible con un episodio neurológico agudo, tras descartar mediante pruebas de imagen una hemorragia intracraneal y, una vez que se descarten otras entidades que justifiquen el cuadro (metabólicas, vasculares, sepsis y otras), esta se atribuya a un fenómeno embólico de origen metastático, la indicación es revertir los efectos de la anticoagulación (al menos transitoriamente) para no transformar un episodio isquémico en hemorrágico o facilitar la hemorragia de un aneurisma micótico. La suspensión del tratamiento anticoagulante durante una a 2 semanas se acompaña de una baja probabilidad de embolias en pacientes portadores de válvula protésica (41, 42, 43) En varios estudios (44) se recomienda discontinuar la anticoagulación en pacientes con EIVP secundaria a estafilococo aureus que presenten embolia en SNC, durante al menos las 2 primeras semanas de tratamiento antibiótico, tiempo en el cual se realizaría la organización del trombo, previniendo transformaciones hemorrágicas.
El posible efecto protector de la terapia antiplaquetaria en embolia en EI fue evaluado en una cohorte retrospectiva de 600 pacientes con EI, 147 de los cuales (25%) tenían un evento embólico sintomático. Los pacientes que habían recibido terapia antiplaquetaria diaria continua por al menos seis meses antes de la hospitalización por EI tenían una tasa significativamente inferior de un evento embólico sintomático (12 contra 28 por ciento sin dicha terapia). El mecanismo presumido es que la agregación plaquetaria juega un papel en la formación de vegetación. La iniciación de la aspirina después del diagnóstico de EI no ofrece beneficios y puede ser perjudicial. Esto fue ilustrado en estudio aleatorizado en el que 115 pacientes con endocarditis infecciosa recibieron aspirina (325 mg/día) o placebo durante cuatro semanas. La aspirina no redujo la incidencia de eventos embólicos, se asoció con una tendencia hacia una mayor incidencia de hemorragia, y no tuvo efecto sobre la resolución de la vegetación o la función valvular.
Según las recomendaciones de Cerebral Embolism Study Group, si la tensión arterial del paciente se encuentra dentro del rango normal y se excluye la presencia de una hemorragia en el SNC, dentro de las 24 a 48 horas del momento del episodio embólico, puede reinstaurarse la terapéutica anticoagulante. En presencia de infartos cerebrales de gran extensión, es prudente esperar 7 días.
Hasta el momento no existe evidencia suficiente para realizar recomendaciones acerca del uso de la terapia trombolítica en pacientes con endocarditis infecciosa que desarrollan manifestaciones en SNC
Dentro de los factores predictores de transformación hemorrágica se incluye la extensión del área infartada, la presencia de pseudo-aneurismas micóticos y el uso temprano de anticoagulantes. Wilson y colaboradores llevaron a cabo un estudio en 52 pacientes con endocarditis de válvula protésica, 38 de los cuales recibieron medicación anticoagulante durante todo el estudio, mientras 14 pacientes suspendieron el manejo anticoagulante o recibieron dosis sub-terapéuticas. Allí, encontraron que la terapia anticoagulante no incrementó de manera significativa la morbimortalidad en pacientes con endocarditis de válvula protésica, y por el contrario, las complicaciones neurológicas y la mortalidad fueron mayores en el grupo de pacientes que suspendieron la terapia anticoagulante (34). Otros estudios reprodujeron resultados semejantes, si bien también existen reportes que relacionan a la terapia anticoagulante con un aumento significativo en el número de complicaciones hemorrágicas derivadas de su uso en pacientes con endocarditis infecciosa en fase aguda (35-37).
Algunos estudios plantean que la incidencia de transformación hemorrágica de eventos inicialmente isquémicos, fue mayor en pacientes con endocarditis de válvula protésica, sobre todo cuando el microorganismo involucrado era el Staphylococcus aureus, ante lo cual recomiendan suspender la anticoagulación hasta que la fase séptica de la enfermedad se haya resuelto (38). Hay una clara contraindicación para el uso de anticoagulantes cuando existe alguna evidencia de transformación hemorrágica en los estudios imagenológicos. El tiempo óptimo para reiniciar la anticoagulación después de un evento cerebrovascular en pacientes con endocarditis infecciosa y válvulas mecánicas cardiacas no ha sido bien establecido, pese a lo cual algunos autores sugieren que la anticoagulación podría reiniciarse después de las dos primeras semanas de ocurrido el evento cerebrovascular, con seguimiento imagenológico para confirmar la ausencia de transformación hemorrágica (41).
Por lo mencionado creo prudente luego de realizado el ecocardiograma transesofágico y descartar criterio quirúrgico reinstaurar la anticoagulación, dado que han pasado 10 días sin anticoagulación, el paciente presenta franca mejoría clínica y nos encontramos frente a lesiones isquémicas pequeñas con menor riesgo de transformación.
Bibliografía:
1- CDC/NHSN Surveillance Definitions for Specific Types of Infections
2- Clara L.; Stern L.; Barcan L.; Marchetti M. y Greco G. Mediastinitis post-quirúrgica:
Estudio caso – control Rev. chil. infectol. v.19 n.1 Santiago 2002.
3- San Juan R, Chaves F, López Gude MJ, et al. Staphylococcus aureus poststernotomy mediastinitis: description of two distinct acquisition pathways with different potential preventive approaches. J Thorac Cardiovasc Surg 2007; 134:670.
4- Fariñas MC, Gald Peralta F, Bernal JM, et al. Suppurative mediastinitis after open-heart surgery: a case-control study covering a seven-year period in Santander, Spain. Clin Infect Dis 1995; 20:272.
5- Trouillet JL, Vuagnat A, Combes A, et al. Acute poststernotomy mediastinitis managed with debridement and closed-drainage aspiration: factors associated with death in the intensive care unit. J Thorac Cardiovasc Surg 2005; 129:518.
6- Jolles H, Henry DA, Roberson JP, et al. Mediastinitis following median sternotomy: CT findings. Radiology 1996; 201:463.
7- Benlolo S, Matéo J, Raskine L, et al. Sternal puncture allows an early diagnosis of poststernotomy mediastinitis. J Thorac Cardiovasc Surg 2003; 125:611.
8- Fowler VG Jr, Kaye KS, Simel DL, et al. Staphylococcus aureus bacteremia after median sternotomy: clinical utility of blood culture results in the identification of postoperative mediastinitis. Circulation 2003; 108:73.
9- Maroto LC, Aguado JM, Carrascal Y, et al. Role of epicardial pacing wire cultures in the diagnosis of poststernotomy mediastinitis. Clinal Infectious Disease 1997; 24:419.
10- Loop FD, Lytle BW, Cosgrove DM, et al. J. Maxwell Chamberlain memorial paper. Sternal wound complications after isolated coronary artery bypass grafting: early and late mortality, morbidity, and cost of care. Ann Thorac Surg 1990; 49:179.
11- Kohli M, Yuan L, Escobar M, et al. A risk index for sternal surgical wound infection after cardiovascular surgery. Infect Control Hosp Epidemiol 2003; 24:17.
12- Dodds Ashley ES, Carroll DN, Engemann JJ, et al. Risk factors for postoperative mediastinitis due to methicillin-resistant Staphylococcus aureus. Clin Infect Dis 2004; 38:1555
13- Karra R, McDermott L, Connelly S, et al. Risk factors for 1-year mortality after postoperative mediastinitis. J Thorac Cardiovasc Surg 2006; 132:537.
14- Dr. Guillermo Careaga Reyna, Dr. Rogelio Campos Ortega Tratamiento de la mediastinitis y otras complicaciones de la esternotomía en cirugía cardiaca Cirujano General Vol. 32 Núm. 4 – 2010
15- Grover FL, Cohen DJ, Oprian C, et al. Determinants of the occurrence of and survival from prosthetic valve endocarditis. Experience of the Veterans Affairs Cooperative Study on Valvular Heart Disease. J Thorac Cardiovasc Surg 1994; 108:207.
16- Millaire A, Van Belle E, de Groote P, et al. Obstruction of the left main coronary ostium due to an aortic vegetation: survival after early surgery. Clin Infect Dis 1996; 22:192.
17- Calderwood SB, Swinski LA, Waternaux CM, et al. Risk factors for the development of prosthetic valve endocarditis. Circulation 1985; 72:31.
18- Grover FL, Cohen DJ, Oprian C, et al. Determinants of the occurrence of and survival from prosthetic valve endocarditis. Experience of the Veterans Affairs Cooperative Study on Valvular Heart Disease. J Thorac Cardiovasc Surg 1994; 108:207
19- Rutledge R, Kim BJ, Applebaum RE. Actuarial analysis of the risk of prosthetic valve endocarditis in 1,598 patients with mechanical and bioprosthetic valves. Arch Surg 1985; 120:469.
20- Ivert TS, Dismukes WE, Cobbs CG, et al. Prosthetic valve endocarditis. Circulation 1984; 69:223.
21- Horstkotte D, Piper C, Niehues R, et al. Late prosthetic valve endocarditis. Eur Heart J 1995; 16 Suppl B:39.
22- Agnihotri AK, McGiffin DC, Galbraith AJ, O'Brien MF. The prevalence of infective endocarditis after aortic valve replacement. J Thorac Cardiovasc Surg 1995; 110:1708.
23- Li J, Sexton D, Mick , et al. Proposed modifications to the Duke criteria for the diagnosis of infective endocarditis. Clin Infect Dis. 2000;30(4):633-8.
24- Roe MT, Abramson MA, Li J, et al. Clinical information determines the impact of transesophageal echocardiography on the diagnosis of infective endocarditis by the duke criteria. Am He J 2000; 139:945.
25- Cheitlin MD, Armstrong WF, Aurigemma GP, et al. ACC/AHA/ASE 2003 guideline update for the clinical application of echocardiography: summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/ASE Committee to Update the 1997 Guidelines for the Clinical Application of Echocardiography). Circulation 2003; 108:1146.
26- Daniel WG, Mügge A, Martin RP, et al. Improvement in the diagnosis of abscesses associated with endocarditis by transesophageal echocardiography. N Engl J Med 1991; 324:795.
27- De Castro S, Cartoni D, d'Amati G, et al. Diagnostic accuracy of transthoracic and multiplane transesophageal echocardiography for valvular perforation in acute infective endocarditis: correlation with anatomic findings. Clin Infect Dis 2000; 30:825.
28- Bayer AS, Bolger AF, Taubert KA, Wilson W, Steckelberg J, Karchmer AW, et al. Diagnosis and management of infective endocarditis and its complications.
29- María Luaces Méndez, Isidre Vilacosta, Cristina Sarriá, Cristina Fernández, José A San Román, Juan V Sanmartín, Javier López, Enrique Rodríguez, Endocarditis infecciosa y embolias del eje hepatoesplenorrenal. Rev Esp Cardiol. 2004;57:1188-96.
30- Vallés Belsué F, Anguita Sánchez M, Escribano Subias MP, Pérez Casar F, Pousibet Sanfeliu H, Tornos Mas P, et al. Guías de práctica clínica de la Sociedad Española de Cardiología en endocarditis.
31- Simsir SA, Cheeseman SH, Lancey RA, Vander Salm TJ, Gammie JS. Staged laparoscopic splenectomy and valve replacement in splenic abscess and infective endocarditis.
32- Pablo Varas Revisión imagenológica de TC en pacientes con mediastinitis en postquirúrgico de cirugía cardiovascular. Universidad Nacional de La Plata, Facultad de Ciencias Médicas 2010.
33- Corral I, Martín-Dávila P, Fortún J, et al. Trends in neurological complications of endocarditis. J Neurol 2007; 254 (9): 1253-9.
34- Heiro M, Nikoskelainen J, Engblom E, Kotilainen E, Marttila R, Kotilainen P. Neurologic manifestations of infective endocarditis: a 17-year experience in a teaching hospital in Finland. Arch Intern Med 2000; 160 (18): 2781-7
35- Silva F, Diaz G; Rodríguez V; Bueno M, Carrillo S; Ruiz N; Castellanos J; Freire I; García, R Complicaciones neurológicas de la endocarditis infecciosa: controversias Rev. Colomb. Cardiol 2011.
36- Martin E. Stryjewski, Lynda A. Szczech, Daniel K. Benjamin, Jr., Jula K. Inrig, Zeina A. Kanafani, John J. Engemann, Vivian H. Chu, Maria J. Joyce, L. Barth Reller, G. Ralph Corey, and Vance G. Fowler, Jr. Use of Vancomycin or First-Generation Cephalosporins for the Treatment of Hemodialysis- Dependent Patients with Methicillin-Susceptible Staphylococcus aureus Bacteremia
37- Marin L Schweizer, Jon P Furuno, Anthony D Harris, J Kristie Johnson, Michelle D Shardell, Jessina C McGregor, Kerri A Thom, Sara E Cosgrove, George Sakoulas and Eli N Perencevich Comparative effectiveness of nafcillin or cefazolin versus vancomycin in methicillin-susceptible Staphylococcus aureus bacteremia BMC Infectious Disease.
38- Kevin W. McConeghy, Susan C. Bleasdale and Keith A. Rodvold The Empirical Combination of Vancomycin and a β-Lactam for Staphylococcal Bacteremia. Clin Infect Dis. (2013) 57 (12): 1760-1765.
39- Hu J, Ma XX, Tian Y, Pang L, Cui LZ, et al. (2013) Reduced Vancomycin Susceptibility Found in Methicillin-Resistant and Methicillin-Sensitive Staphylococcus aureus Clinical Isolates in Northeast China. PLoS ONE 8(9): e73300.
40- Bonow, RO, Carabello, BA, Chatterjee, K, et al. ACC/AHA 2006 guidelines for the management of patients with valvular heart disease. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing committee to revise the 1998 guidelines for the management of patients with valvular heart disease). J Am Coll Cardiol 2006; 48:e1.
41- Miller N, Pauker SG, Salem DM, Stein PD, Al-Ahmad A, Bussey HI, et-al. The Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest. 2004;126:457-82.
42- Delahaye JP, Poncet P, Malquarti V, Beaune J, Gare JP, Mann J.M. Cerebrovascular accidents in infective endocarditis: Role of anticoagulation. Eur Heart J. 1990;11:1074-8.
43- Phan GT, Koh M, Wijdicks E.F.M. Safety of discontinuation of anticoagulation in patients with intracranial hemorrhage at high tromboembolic risk. Arch Neurol. 2000;57:1710-3.
44- Tornos P, Almirante B, Mirabet S, Permanyer G, Pahissa A, Soler-Soler J. Infective endocarditis due to Staphylococcus aureus: deleterious effect of anticoagulant therapy. Arch Intern Med. 1999;159:473– 475.
45- Wilson WR, Geraci JE, Danielson GK, et al. Anticoagulant therapy and central nervous system complications in patients with prosthetic valve endocarditis. Circulation 1978; 57:1004.
46- Leport C, Vilde JL, Bricaire F, et al. Fifty cases of late prosthetic valve endocarditis: improvement in prognosis over a 15 year period. Br Heart J 1987; 58:66.
47- Salem DN, O'Gara PT, Madias C, et al. Valvular and structural heart disease: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest 2008; 133:593S.
48- Immediate anticoagulation of embolic stroke: a randomized trial. Cerebral Embolism Study Group. Stroke 1983; 14:668.
49- Immediate anticoagulation of embolic stroke: brain hemorrhage and management options. Cerebral Embolism Study Group. Stroke 1984; 15:779.
|
|
|
Discusión |
|
La discusión de este seminario
corresponde al 20 de Marzo de 2014, a
cargo de Dra. Bellagamba, Claudia |
|
| |
|
|
| |
|
|
|
|
|