|
Discusión del
caso clínico
Dr. Eduardo
González
Se discute el caso de una mujer de 51 años, con
antecedente de Linfoma no Hodgkin para el que realizó
como tratamiento de la recaída un trasplante de
progenitores hematopoyéticos hace 2 meses, con serología
pretrasplante positiva para Citomegalovirus (CMV), que
consulta por un cuadro respiratorio con hallazgos en los
estudios complementarios de plaquetopenia y positividad
en la búsqueda de ADN de CMV por Reacción en Cadena de
la Polimerasa (PCR).
Se denomina Trasplante de Progenitores
Hematopoyéticos (TPH) al procedimiento que intenta
la reconstitución del sistema hematopoyético por
transferencia de células pluripotentes (stem cells o
células madres). Su finalidad puede generalizarse en 2
puntos: reemplazar una médula ósea (MO) anormal por
enfermedades linfohematopoyéticas no malignas o permitir
dosis más altas de quimioterapias mielosupresivas para
el tratamiento de tumores tanto sólidos como
hematológicos. Las células madre tienen algunas
características que hacen posible su trasplante: poseen
una alta capacidad de regeneración, tienen llegada a la
MO desde sangre periférica, y son pasibles de ser
criopreservadas. Para citar un poco de historia, cabe
mencionar que en el año 1956 fue cuando Donald Thomasa
realizó el primer trasplante de médula ósea exitoso con
un donante vivo relacionado.
Los trasplantes de progenitores hematopoyéticos pueden
clasificarse según el donante y según la fuente de las
células. Los donantes pueden ser autólogos, siendo al
mismo paciente al que se extraen las células madres para
que luego de un proceso específico le sean
reimplantadas, o alogénico, cuando el donante no es
inmunológicamente idéntico pero está emparentado según
el complejo mayor de histocompatibilidad. En este último
tipo es donde hay probabilidades que aparezcan dos de
las complicaciones más importantes del trasplante: el
rechazo del injerto y la enfermedad injerto contra
huésped (EICH). La fuente de las células pueden ser la
médula ósea, la sangre periférica o la sangre del cordón
umbilical. Antiguamente se denominaba al TPH como
Trasplante de Médula Ósea (TMO) debido a que la fuente
principal era la misma MO; sin embargo, con los avances
biotecnológicos se hizo factible obtener células madre
de la sangre periférica y del cordón umbilical por lo
que la denominación se amplió.
Como ejemplos de las enfermedades en las que el TPH
tiene utilidad se pueden mencionar inmunodeficiencias,
anemia aplásica y hemoglobinopatías entre las
enfermedades no malignas, y leucemia aguda, leucemia
crónica, mielodisplasia, linfomas, mieloma y tumores
sólidos entre las enfermedades malignas.
Las
complicaciones que pueden presentarse se dividen de
acuerdo al período en que se presenten, en relación a la
implantación y reproducción de las células madres.
|
1er período |
2do período |
3er período |
|
Día o a 30 |
Días 30 a 100 |
> 100 días |
|
Fase pre-engrafment |
Fase post-engrafment
inmediata |
Fase post-engraftment
tardía |
Entre los
efecto directo de quimioterápicos podemos mencionar las
náuseas y vómitos, las mucositis oral, la enfermedad
hepática venooclusiva y la neumonía intersticial entre
los tempranos. Entre los tardíos caben mencionar a la
azospermia y falla ovárica, la disfunción tiroidea, la
aparición de cataratas y la necrosis aséptica femoral.
Una de
las complicaciones más temibles, y que se presenta
exclusivamente en trasplantados alogénicos, es la
enfermedad injerto contra huésped (EICH). La misma, está
mediada por células T alogénicas contra antígenos del
huésped. Puede clasificarse en aguda (antes de los 3
meses) o crónica (luego de los 3 meses). La EICH aguda
se caracteriza por la aparición de un rash eritematoso
maculopapular, anorexia, diarrea como manifestación
gastroenterológica y alteraciones hepáticas. Como la
clínica es inespecífica, la confirmación debe hacerse
por biopsia. En la piel se evidencia daño epidérmico y
de folículos pilosos, en el hígado disrupción
segmentaria de canalículos biliares y en el intestino
destrucción de criptas y ulceración mucosa. La
prevención se basa en la administración de agentes
inmunosupresores, entre los que se destacan metotrexato,
ciclosporina, tacrolimus, prednisona, Ac anti células T
y micofenolato, y en la remoción de células T del
inoculo a administrar. Cuando la enfermedad esta
instaurada, el tratamiento se basa en prednisona,
globulina antitimocítica y ac monoclonales anti células
T. La EICH crónica se manifiesta por rash malar,
síndrome seco, artritis, bronquiolitis obliterante y
degeneración biliar ductal como cuadros principales.
Otra de
las complicaciones es la falla del injerto, evidenciado
por la falta de incremento en los recuentos celulares de
las 3 series. Su patogenia puede recaer en: número
inadecuado de células trasplantadas, daño celular
durante el tratamiento ex vivo o en el almacenado,
exposición a agentes mielotóxicos post trasplante,
infección por CMV o VHH tipo 6 o rechazo inmunológico.
Para
finalizar con las principales complicaciones post TPH,
las infecciones ocupan un lugar relevante. La frecuencia
con las que se presentan varían de acuerdo con el
período post trasplante en el que se encuentre el
paciente. No obstante, las bacterianas y las virales
ocupan un lugar principal, sin dejar de ser las
micóticas un punto importantísimo a evaluar. Los
factores de riesgo para presentar cualquier tipo de
infección son: el tipo de enfermedad subyacente, el
grado de neutropenia, la falla del injerto, un recuento
de CD4 < 200/mm3, la edad > 40 años, la insuficiencia
hepática o pulmonar, que el trasplante sea alogénico, la
depleción de células T, la mucositis severa, la falla
renal, la enfermedad injerto contra huésped grado II a
IV, la pérdida de barrera cutánea y el tratamiento con
corticoides a dosis inmunosupresoras.
La
paciente de este caso presenta como dato guía-problema
una disminución del número de plaquetas luego de haber
alcanzado un número normal posterior al trasplante. Se
define como plaquetopenia al recuento menor a
150.000/mm3; sin embargo cabe mencionar que
hasta el 2% de la población presenta valores por debajo
de ese número sin ser esta un hallazgo patológico y que
la incorrecta relación entre el anticoagulante de la
muestra (EDTA) y la sangre puede dar un valor espurio
anormalmente bajo. En grandes rasgos, el estudio de la
plaquetopenia puede dividirse según: disminución de la
producción, entre las que destacan las infecciones
virales (rubeola, paperas, varicela, parvovirus,
hepatitis C, VEB, VIH, CMV), los efectos directos de la
quimioterapia y la radioterapia, la toxicidad por el
alcohol y el déficit de vitamina B12 y ácido fólico, y
en aumento de la destrucción, entre las que se pueden
mencionar la púrpura trombocitopénica idiopática y el
lupus eritematoso sistémico, la destrucción aloinmune,
la púrpura trombótica trombocitopénica y el síndrome
urémico hemolítico, el síndrome antifosfolipídico, el
síndrome HELLP, algunas drogas (heparina, valproato,
quinidina, cotrimoxazol) y las infecciones virales (CMV,
VEB, VIH). Dentro de las causas que podrían pensarse en
esta paciente (destrucción aloinmune, drogas,
infecciones virales, quimioterapia, radioterapia,
alcohol, déficit de vitamina B12 y ácido fólico, falla
en el injerto y enfermedad injerto contra huésped),
considero que las infecciones virales, entre las que
destaca el CMV, juegan un rol fundamental, quedando de
lado el resto en base a los antecedentes y la evolución.
El
Citomegalovirus (CMV) pertenece a la familia de los
herpesvirus; se caracteriza por producir inclusiones
intranucleares y citoplasmáticas bien particulares.
Presenta una distribución mundial, con una alta
frecuencia que va desde el 50 al 90% según el grupo
estudiado y una transmisión posible por mucosa oral,
ocular, genital y anal, vía respiratoria y vía
sanguínea. Se pueden describir 4 tipos de enfermedades:
congénita, perinatal, un síndrome mononucleósico y la
infección en el inmunocomprometido (dividiendo este
último punto en pacientes con serología positiva para
Virus de la Inmunodeficiencia Humana y en pacientes
trasplantados). En los pacientes TPH el CMV puede
presentarse como: neumonía intersticial (cuadro
respiratorio con variabilidad imagenológica pero con
gran mortalidad sin tratamiento), fiebre de origen
desconocido, afección del tubo digestivo caracterizada
por enteritis, esofagitis, gastritis o colitis,
retinitis, encefalitis, hepatitis, supresión medular y
un cuadro de infección diseminada fatal. En el
diagnóstico la clínica puede orientar pero se requieren
de métodos de laboratorio para confirmarla. La serología
(IgM anti CMV) no es útil en el seguimiento del TCH,
debido a que la misma puede permanecer positiva meses
después de la infección y no ser un marcador claro de la
enfermedad. Lo mismo sucede con el cultivo virológico,
siendo una técnica en desuso actualmente. Los
anticuerpos monoclonales se utilizan para la evaluación
inmunohistoquímica. La detección Ag CMV (pp65) es uno de
los métodos que se utilizan en el presente para definir
infección y enfermedad, con una tasa del 5 a 10% de
falsos negativos. No obstante, la amplificación ADN CMV
por PCR es el método más sensible (1 a 3% falsos
negativos). Estos dos últimos marcadores son los que
actualmente se utilizan en el seguimiento del paciente
con TPH. La prevención de la infección por CMV se
intenta realizar utilizando donantes seronegativos
(estrategia muy difícil de emplear en nuestro medio, que
posee una incidencia de serología positiva para CMV
mayor al 90%) y realizando procesos específicos a la
muestra de sangre (congelamiento, descongelamiento y
deglicerolizción). Puede realizarse profilaxis primaria,
que está destinada a pacientes en riesgo. Esta se basa
según el estado serológico pre-trasplante, siendo los
receptores negativos que reciben células de donantes
positivos y los receptores positivos que reciben células
de donantes tanto negativos como positivos los pacientes
de mayor riesgo. La misma se puede realizar con:
ganciclovir 5 mg/kg cada 12 hs por 5 días y luego
diariamente hasta el día 100, aciclovir a altas dosis
durante 6 meses, valaciclovir o cidofovir. Un punto muy
importante es el llamado tratamiento antiviral temprano
(anticipatorio), que está destinado a pacientes con
evidencia de infección por CMV (cultivo viral de sangre,
orina, faringe o lavado bronquioloalveolar o Ag pp65 CMV
o PCR ADN CMV en sangre) sin enfermedad clínica. El
objetivo es la detección temprana de la infección, para
prevenir la progresión a enfermedad. La terapéutica
farmacológica en este punto se basa en ganciclovir,
valganciclovir, foscarnet y cidofovir. Cuando la
enfermedad esta instaurada, el tratamiento varía de
acuerdo al órgano afectado:
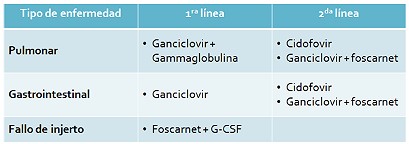
Para
finalizar el análisis del caso, cabe mencionar que los
pacientes con TPH pueden presentar
complicaciones pulmonares relacionadas al mismo.
Estas se pueden dividir en tempranas y tardías. Entre
las primeras cabe destacar: las bacterianas, la
aspergilosis, candidiasis, mucormicosis, la neumonía por
P. jiroveci y las virales por VHS, el edema
pulmonar, la broncoaspiración 2ria a
mucositis, el daño alveolar difuso por toxicidad por
quimioterapia o radioterapia y la hemorragia alveolar
difusa. Dentro de las tardías, la bronquiolitis
obliterante y tomando mayor relevancia la enfermedad
restrictiva que se observa con mayor frecuencia en este
subgrupo de pacientes.
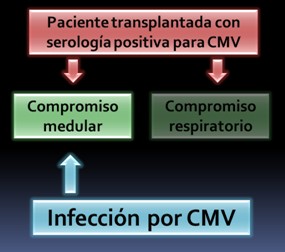
Como
conclusión, considero que el compromiso medular (plaquetopenia)
puede ser explicado por la infección por CMV sustentado
en la positividad de la PCR para ADN CMV y en la
relación temporal con el TPH. Respecto al compromiso
respiratorio, si bien podría ser tentador atribuírselo
al CMV, considero que fue un cuadro banal de vías aéreas
superiores con autolimitación.
Como
conducta propongo continuar tratamiento con
ganciclovir hasta negativización de pp65 (dos muestras
como mínimo) o PCR ADN CMV, con control estricto de
efectos adversos de la medicación, entre los que destaca
la neutropenia. A su vez, continuar controles
periódicos, clínicos y bioquímicos, para detección
temprana de infecciones y recaída post trasplante.
Al día de hoy, 5588 personas en Argentina esperan por un
dador…
La donación de órganos salva vidas.
Bibliografía:
1)
Anaissie E. “Overview of infections following
hematopoietic cell transplantation”. En: Up To Date,
Rose, BD(Ed), Up To Date, 2007.
2)
Anaissie E. “Prophylaxis of infections in
hematopoietic cell transplant recipients”. En: Up To
Date, Rose, BD(Ed), Up To Date, 2007.
3)
Apellbaum F. “Hematopoietic cell transplantation”. En:
Harrison's Internal Medicine. 17 Ed.
Mc Graw
Hill. 2007. Capítulo 108. Versión electrónica.
4)
Cozzi J. Citomegalovirus. “Estrategias actuales de
prevención y tratamiento en Receptores de Trasplante de
Progenitores Hematopoyéticos”. En: Publicación digital
de la 1ra Cátedra de Clínica Médica y Terapéutica y la
Carrera de Posgrado de Especialización en Clínica
Médica. Artículos especiales. www. clinica-unr.org
5)
Crumpacker C, Wadhwa S. “Cytomegalovirus”. En: Mandell,
Bennett, & Dolin: Principles and Practice of Infectious
Diseases, 6th ed. 2005.
Churchill Livingstone. 1787 - 1801.
6)
Hirsh M. “Cytomegalovirus and Human Herpesvirus Types 6,
7, and 8”.
En: Harrison's Internal Medicine. 17
Ed. Mc Graw Hill. 2007. Capítulo 175. Versión
electrónica.
7)
Landaw S, George J. “Approach to the adult
patient with thrombocytopenia”. En: Up To Date, Rose,
BD(Ed), Up To Date, 2007.
8)
Mattsson J, Ringdén O, Storb R. “Graft Failure after
Allogeneic Hematopoietic Cell Transplantation”.
Biol Blood Marrow Transplant 2008; 14: 165–170.
|
|
|
Discusión |
|
La discusión de este seminario
corresponde al 7 de mayo de 2009, a cargo del
Dr. Eduardo González. |
|
| |
|
|
| |
|
|
| |
|