|
Dossier del mes: Síndrome Confusional Agudo en UCI
Dr. Javier Montero.
* Coordinador General de la Sección Literatura Científica Seleccionada. Departamento de Medicina Interna. Hospital Povisa, Vigo, España. Mail: jjmmmontero@yahoo.com.ar
1. Introducción
El Síndrome Coranario Agudo (SCA) es la manifestación de disfunción cerebral más común en el paciente crítico. Su prevalencia en Unidades de Cuidados Intensivos (UCI) médicas y quirúrgicas varía entre un 35 y 80% dependiendo de la severidad de los síntomas interpretados como tal y de la sensibilidad de la herramienta diagnóstica utilizada [1-4]. Su importancia radica en que su desarrollo en pacientes críticos se asocia a una prolongación del tiempo de ventilación mecánica y de estancia hospitalaria, y constituye un factor de riesgo independiente de mortalidad a corto y largo plazo [5-7].
2. Definición y subtipos de SCA
El SCA o Delirium se define como una alteración de la conciencia de aparición aguda (en un período de horas o pocos días) y curso fluctuante en el tiempo, caracterizada principalmente por alteraciones de la atención (inatención o estado de alerta permanente) acompañado de alteraciones cognitivas (alteraciones de la memoria, desorientación, agitación o habla confusa, apatía o aislamiento) y/o de la percepción (alucinaciones usualmente visuales y/o ilusiones) secundario a una causa orgánica [1,6,9].
De acuerdo con el nivel de alerta y de actividad psicomotora, el SCA puede clasificarse en: 1) Hiperactivo o “Clásico”: caracterizado por agitación, agresividad, inquietud, labilidad emocional, tendencia a retirarse sondas, catéteres y tubos, etc; 2) Hipoactivo: se caracteriza por indiferencia afectiva (interpretado como “depresión”), apatía, letargia y disminución en la respuesta a estímulos externos; 3) Mixto: presenta características de los dos anteriores. La prevalencia de cada subtipo de SCA es muy variable según los estudios. Los subtipos más frecuentes en UCI son el SCA Mixto y el SCA Hipoactivo [6-9].
Se acepta universalmente que el diagnóstico de SCA se base en los criterios del Manual Diagnóstico y Estadístico de los Trastornos Mentales (Diagnostic and Statistical Manual of Mental Disorders -DSM IV-) propuestos por la Asociación Americana de Psiquiatría en el año 2.000 (tabla 1) [6].

Resumidamente, los cuatro criterios diagnósticos son: 1. Trastorno de conciencia y la atención; 2. Trastorno cognitivo, del conocimiento o la percepción, que no se explica por la existencia previa de demencia; 3. El trastorno se desarrolla en un periodo corto de tiempo (habitualmente horas o días), y tiende a fluctuar a lo largo del día; 4. Evidencia por la anamnesis, exploración física o exámenes complementarios de que el trastorno está causado por una condición médica general.
3. Reseña fisiopatológica
El SCA suele resultar de la combinación del trinomio factorial compuesto por los antecedentes personales del paciente, las circunstancias ambientales y factores desencadenantes [1,2,8,10]. Entre los primeros, la edad avanzada, las alteraciones cognitivas previas, visuales y/o auditivas, el consumo de sustancias con capacidad adictiva (alcohol, nicotina y psicofármacos) y la presencia de múltiples comorbilidades, son los más importantes. Dentro de los factores ambientales en UCI se incluyen inmovilidad prolongada, estancia prolongada, práctica de intervenciones y procedimientos sobre el enfermo, sujeciones físicas, privación o sobreestimulación sensorial, privación de sueño, ventilación mecánica, uso de fármacos psicoactivos (en especial, benzodiacepinas y opiaceos).
En estos pacientes, múltiples factores pueden actuar como desencadenantes del SCA (tabla 2). Una enfermedad aguda (infección, anemia, hipoxia, hipotensión, trastornos del sodio, deshidratación, etc.), el dolor insuficientemente tratado o el uso de fármacos psicoactivos, en especial opiáceos y benzodiacepinas, pueden favorecer su aparición. El delirio puede ser la primera manifestación de un problema potencialmente grave que requiere una resolución inmediata [1,10].

El mecanismo patogénico exacto del disturbio mental que ocurre en el SCA no ha sido claramente caracterizado, aunque se reconoce que puede ser multifactorial y es probable que cada causa de SCA actúe con bases fisiopatológicas distintas [1,7,10,13]. Por ejemplo, se ha postulado que en la sepsis la inflamación sistémica juega un rol significativo en la disfunción de múltiples órganos, incluido el cerebro, al iniciar una cascada de daño endotelial, formación de trombos y compromiso microvascular [7,13]; mientras tanto, en los trastornos del sodio, los cambios en la composición de solutos intra y extracelular y en el transporte de agua a través de la membrana neuronal pueden alterar drásticamente su función y expresarse clínicamente como SCA [14].
Lo que sí parece más claro es el trastorno químico cerebral que ocurre como respuesta dichas agresiones. Una vez gatillados los mecanismos fisiopatogénicos particulares por cada agente etiológico (sepsis, edema cerebral, etc.), ocurre un desbalance de neurotransmisores que lleva a un exceso de la actividad dopaminérgica y consecuente depleción colinérgica, resultante en una inestabilidad neuronal que se expresa clínicamente con los signos y síntomas que conforman el SCA. Probablemente otros neurotransmisores como acido amino butírico (GABA), serotonina, endorfinas, y glutamato puedan estar involucrados. En este sustrato fisiopatogénico se basa el tratamiento sintomático actual del SCA (antipsicóticos típicos y atípicos, antidepresivos, etc) [1,5,7,10].
4. Herramientas diagnóstica del SCA en UCI
El método más sensible y específico para el diagnóstico de SCA en el paciente no crítico es el denominado Método de Valoración de la Confusión (Confusion Assessment Method -CAM-; ver Anexo, Tabla 3). Este consta de 4 ítems: presencia de inatención, aparición aguda y curso fluctuante, pensamiento desorganizado y trastorno del nivel de conciencia. La presencia de los 2 primeros criterios más uno de los 2 últimos define al SCA [1].

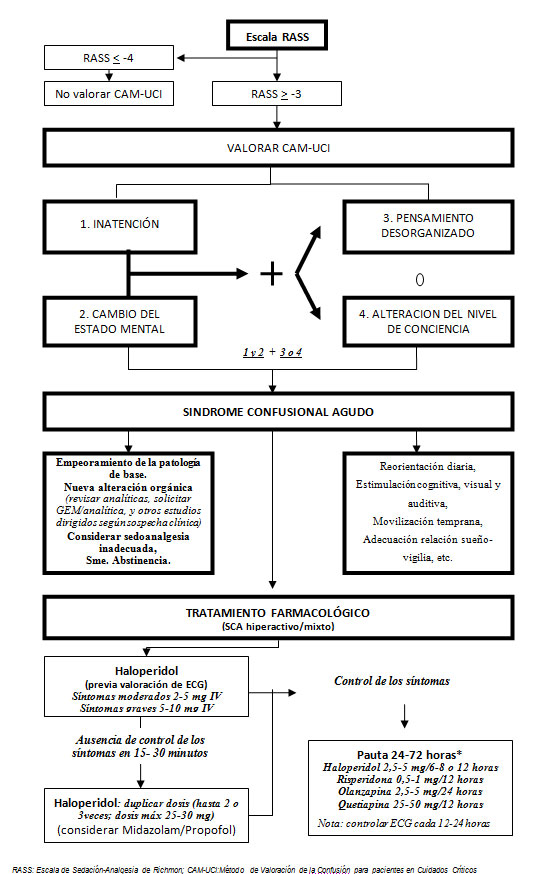
Para el diagnóstico en UCI, se utiliza una adaptación del mismo denominado CAM-UCI (Anexo UCI-CAM). Este puede realizarse en pacientes intubados o no, y consta de dos pasos: primero, se debe determinar el nivel de conciencia a través de la Escala de Ritchmond de Agitación-Sedación (Richmond Agitation-Sedation Scale –RASS–) y, luego, debe valorarse el contenido de la conciencia a través del CAM adaptado a UCI. El UCI-CAM fue validado para el idioma español adecuadamente presentando una sensibilidad y especificidad mayores al 90% [9].
De forma práctica, para valorar la puntuación RASS, observamos al paciente: 1º) Si está despierto, inquieto o agitado, puntuar de 0 a +4; 2º) Si no está despierto, llamarlo por su nombre y pedirle que abra los ojos y mire al examinador; si los abre o responde con movimientos, puntuar de -1 a -3; 3º) Si no responde a la llamada, estimular al paciente dándole palmadas en el hombro y/o frotándole el esternón, y puntuar - 4 ó - 5 según la respuesta. Si el paciente se puntúa por encima de -3 por la escala RASS, se procede a analizar el contenido de la conciencia a través del CAM para el diagnóstico definitivo del síndrome [7,9,10].
Otra herramienta para el diagnóstico del SCA en UCI es el Listado para la Detección del Delirio en UCI (Intensive Care Delirium Screening Checklist [IC-DSC]) [11]. Este método es algo más de engorroso de realizar y no está validado al español aún; por esto se suele optar por el CAM-UCI.
Es evidente que estos métodos diagnósticos, tanto el CAM-UCI como IC-DSC, se apoyan en exceso en la presencia de alteración del nivel de conciencia para el diagnóstico de SCA, situación extremadamente frecuente en pacientes en UCI que reciben sedación, muchas veces intermitentemente. Esta es una de las principales críticas que se les hace a estas herramientas diagnósticas ya que pueden sobreestimar la incidencia del SCA [12]. Sin embargo, la mayoría de las entidades encargadas de dictaminar protocolos de actuación en las UCI, proponen establecer en todos los pacientes un sistema de monitorización rutinaria del delirio que pueda servir como indicador de calidad.
5. Manejo del SCA en UCI
Una vez detectado el SCA por la herramienta diagnóstica que sea, debe intentar identificarse la causa orgánica/médica subyacente. Luego, o mientras se intenta detectar la misma, se debe proveer medidas de preventivas para evitar la progresión del cuadro, y en algunos casos, realizar tratamiento farmacológico de los síntomas del delirio [1,5,7,10].
Identificación y tratamiento etiológico del SCA.
Si bien el SCA en UCI es expresión de disfunción cerebral secundario a causas que podríamos decir “menores” (sedación inadecuada, dolor insuficientemente tratado, privación de sueño, etc.), el SCA puede ser la primera manifestación de un problema potencialmente grave que requiere una resolución inmediata [1,7,10].
Inicialmente se debe analizar si la enfermedad actual o su tratamiento están contribuyendo directamente para la producción del cuadro para lo cual habrá que revisar la historia clínica del paciente y considerar si el cuadro actual puede ser consecuencia de su evolución.
A continuación, debe descartarse alteraciones hidroelectrolíticas o metabólicas (hipo e hipernatremia, hipercalcemia, hipoglucemia, hipoxemia, hipercapnia, uremia, insuficiencia hepática), presencia de infección nueva, baja perfusión tisular (shock encubierto), analgesia inadecuada, o abstinencia de alcohol o sedantes [10]. Para esto deberá realizarse un examen físico dirigido, revisar analíticas previas y valorar una nueva de considerarse necesario, evaluar fármacos recientemente introducidos y solicitar estudios dirigidos según la sospecha clínica (gasometría, hemograma y analítica básica, estudios por imágenes, etc.).
Una vez descartadas al menos las causas potencialmente graves del SCA, se debe reforzar o poner en marcha las medidas preventivas/ambientales dirigidas a la reorientación del paciente y valorar la necesidad de iniciar un tratamiento farmacológico preciso [1,7,10].
Medidas preventivas o no farmacológicas.
Una vez detectado el síndrome, las estrategias preventivas pueden ayudar a controlar el cuadro y a evitar, o reducir, la necesidad de administrar fármacos. Estas medidas deben estar a cargo de todo el equipo involucrado en la asistencia del paciente crítico (enfermería, auxiliares, cuerpo médico, etc.). Las medidas preventivas incluyen la reorientación, la estimulación cognitiva varias veces al día, la estimulación visual y auditiva, la movilización temprana, la retirada precoz de catéteres, el manejo adecuado del dolor, adecuar el ciclo sueño-vigilia y minimizar en lo posible el ruido y la luz artificial. Con estas intervenciones se reduce hasta en un 40% la incidencia del delirio. En la tabla 5 se enumeran las medidas preventivas.

Tratamiento farmacológico.
En UCI es frecuente que el factor desencadenante del SCA no pueda resolverse rápidamente o incluso no se detecte inicialmente una vez descartados los problemas potencialmente graves. En estos casos se deben controlar los síntomas con fármacos [10].
Los antipsicóticos (APs) son los fármacos más efectivos. Ejercen un efecto estabilizador de la función cerebral al antagonizar la neurotransmisión dopaminérgica. Debido a que no existen diferencia significativas en cuanto a eficacia entre los distintos tipos de APs, típicos y atípicos, la elección del fármaco debe basarse en su perfil farmacocinético, forma de administración, potencia, efecto sedante y sus posibles efectos secundarios [7,13].
El haloperidol es el fármaco más estudiado, se puede usar por vía parenteral y se recomienda como primera elección. Los APs atípicos suelen utilizarse cuando se requieren dosis altas del primero para el control de síntomas o cuando hay un mayor riesgo de desarrollar efectos adversos extrapiramidales o cardíacos [1,7,10,13]. Las benzodiacepinas (BDP) en monoterapia han demostrado ser menos eficaces, pueden empeorar o perpetuar el SCA y suelen asociarse a un mayor número de eventos adversos comparado con los APs. Estos sólo deben utilizarse en el SCA secundario a abstinencia alcohólica o de sedantes, y para el control rápido de los síntomas cuando la agitación es grave [1,10,13]. A continuación se detallarán los fármacos que se utilizan para el manejo del SCA.
Antipsicóticos
El Haloperidol (HPD) es el antipsicótico típico de elección para el tratamiento del SCA. Su mecanismo antipsicótico está relacionado con el bloqueo de receptores dopaminérgicos (D2) particularmente en el cuerpo estriado. También actúa sobre otros receptores (adrenérgicos, colinérgicos y de serotonina) [7,10]. La vía, dosis y frecuencia de administración dependen de la intensidad de la agitación y el riesgo de efectos adversos. Inicialmente se suele utilizar por vía intravenosa (IV) con un inicio y pico de acción a los 5-20 y 15-45 minutos, respectivamente. Se metaboliza en el hígado y el 20% se excreta como metabolitos activos por el riñón. La vida media varía entre 12 y 36 horas, aunque la correlación ente ésta y la duración de acción farmacológico no es buena y suele requerirse una administración más frecuente (por ejemplo, cada 4-8 horas).
El esquema terapéutico recomendado en el delirio hiperactivo es el siguiente: dosis inicial 0,5-2 mg IV cuando la sintomatología es leve; 2-5 mg si la sintomatología es moderada y 5-10 mg en casos graves. Si no se consigue un control de los síntomas en 15-30 minutos, se puede repetir la dosis y si la agitación persiste, se deberá doblar la dosis cada 20-30 minutos hasta que ésta cese (neuroleptización). La dosis media requerida para el control de los síntomas suele ser de 30 mg, y no se sugiere utilizar dosis mayores de 50 mg/día. En casos de agitación grave, la asociación de dosis aisladas de midazolam (3-5 mg) o propofol (20-30 mg) puede permitir un control más rápido de los síntomas y una reducción en la dosis total diaria posterior del antipsicótico. Una vez controlada la situación, se recomienda una dosis de mantenimiento entre 2 y 5 mg cada 6-12 horas IV o por vía oral (biodisponibilidad 60%, inicio y pico de acción 30-60 minutos y 2-4 horas, respectivamente), durante 3 a 5 días y luego ir reduciendo la dosis gradualmente en 48 horas.
El HPD, incluso por vía IV, se asocia con una incidencia baja de efectos adversos. Las manifestaciones extrapiramidales como la distonía aguda (el más frecuente), acatisia o el parkinsonismo, son los efectos secundarios más comunes, y salvo la excepcional distonía de músculos respiratorios o laríngeos (que debe tratarse con medidas de soporte y biperideno -Akineton®-), no suelen ser graves. Los efectos cardiovasculares, cuya incidencia varía entre 0,5 y 3%, son la hipotensión, en general relacionada con un estado de hipovolemia u otra condición favorecedora del mismo (sepsis, por ejemplo), y las arritmias (trastornos de conducción, prolongación del intervalo QTc y torsade de pointes). Estos últimos efectos suelen ocurrir en ancianos, pacientes con cardiopatía previa, y tras la administración de dosis superiores a 50-140 mg/día, si bien se han descripto con dosis menores (30 mg/día) lo que habla de un efecto probablemente idiosincrático. Por último, el síndrome neuroléptico maligno es el menos frecuente de los efectos adversos (<2,5%) aunque con una mortalidad que puede alcanzar el 20%. Los pacientes con trauma cerebral parecen ser más susceptibles a esta complicación. La bromocriptina a dosis de 5-10 mg/8 horas junto a dandroleno IV son los recursos terapéuticos disponibles para el caso.
Los antipsicóticos atípicos o de segunda generación actúan como antagonistas tanto a nivel dopaminérgico como de otros neurotransmisores incluidos serotonina, acetilcolina y noradrenalina [7]. Al presentar una fácil disociación de los receptores dopaminérgicos, presentan menor incidencia efectos extrapiramidales [10]. La Risperidona (RPD) y Olanzapina (OLZ) son los fármacos más estudiados. Los pocos trabajos bien diseñados metodológicamente disponibles hasta la fecha, han demostrado lograr el control sintomático precozmente en comparación con el HPD, aunque esto no hubo diferencias en los días de ventilación, estancia en UCI, y mortalidad. Los efectos adversos extrapiramidales son menos frecuentes [10,15,16].
Ambos fármacos se administran por vía oral (VO) o enteral por sonda nasogástrica, tienen una buena biodisponibilidad (60-70%) y vidas medias prolongadas (entre 20 y 40 horas). La RPD se elimina por vía renal, mientras que la OZP se metaboliza en el hígado. El segundo tiene más efecto sedante que el primero. El esquema terapéutico de la RPD es de 0,25-0,5 mg por VO cuando la sintomatología es leve, para aumentarse progresivamente si no se controla el cuadro hasta una dosis máxima 6 mg/día en 2 o 4 tomas. Para la OZP se propone una dosis inicial de 2,5 o 5 mg/día y una dosis máxima 15 mg/día (en 1 o 2 tomas).
Las principales limitaciones de estos fármacos son que al administrarse por vía oral, estos fármacos requieren de una vía enteral funcionante (no siempre disponible en pacientes en UCI) y que en cuadros de agitación grave tienen un comienzo de efecto más lento.
Los efectos adversos más comunes con esta clase de fármacos son la sedación y los efectos anticolinérgicos (constipación, boca seca, taquicardia, etc.). La incidencia de efectos adversos extrapiramidales es menor que con HPD cuando se utilizan dosis altas para el control del delirio. Los efectos cardiovasculares que ocurren con HPD (prolongación del QT, torsades, etc.) también ocurren con los antipsicóticos atípicos y un estudio retrospectivo reciente demostró que la incidencia de efectos cardiovasculares es similar a los antipsicóticos típicos [17]. Se ha descrito un mayor riesgo de hiperglucemia grave y cetosis en pacientes tratados con APs atípicos principalmente con OZP. Por este motivo, se recomienda monitorizar la glucemia durante el tratamiento, especialmente en pacientes diabéticos o con factores de riesgo para hiperglucemia [10].
Quetiapina (QTP) es un antipsicótico atípico recientemente introducido cuyas principales virtudes farmacocinéticas son su vida media corta (6 horas) y que no se ajusta por la función renal (metabolismo hepático). Comparado con placebo, ha demostrado lograr un control rápido de los síntomas y ser seguro, aunque no se encontraron diferencias en duración de VM, tiempo en UCI y mortalidad [18]. Hasta el momento no hay estudios comparativos con otros antipsicóticos. La dosis inicial de QTP es 25-50 mg cada 12 horas (dosis máxima 400 mg/12 horas) titulando el aumento de dosis de 25 mg/12 horas, cada 24 horas. La ziprazidona ha sido recientemente estudiada sin demasiado éxito (MIND trial) [19].
Siempre que se utilice un antipsicótico, sea típico o atípico, debe tomarse las precauciones necesarias para evitar los efectos adversos, principalmente los cardiovasculares. Deben utilizarse estrategias para evitar el uso de dosis inadecuadamente altas en los delirios graves (combinar midazolam o propofol en la agitación grave), controlarse el intervalo QT electrocardiográficamente (y suspenderlos si se prolonga más del 25% del intervalo QT basal), mantener potasio, calcio y magnesio en rangos normales durante su utilización.
Benzodiacepinas y Propofol
Las benzodiacepinas (BDP) son menos efectivos que los antipsicóticos, presentan mayor incidencia de efectos adversos e incluso, han sido involucrados en la precipitación del SCA. Por esto, su utilización se recomienda exclusivamente para los casos de SCA secundario a abstinencia alcohólica o por BDP, y para el control rápido de la agitación grave [10]. Se recomienda el midazolam por ser de vida media corta. Dependiendo del grado de agitación, puede iniciarse una dosis carga de 3, 5 o 10 mg y posteriormente una perfusión de 3 a 10 mg/hora (de utilizar la última, debe controlar y protegerse la vía aérea). El propofol es una alternativa al midazolam. La dosis de carga es de 0,5 mg/kg en 10-20 segundos (con bolos extras de 20 mg de ser necesario) y posteriormente se puede perfundir a 0,3 mg/kg/hora.
Otros fármacos
La trazodona es un antidepresivo que tiene efectos antiserotoninérgicos sobre receptores 5HT2. Parecen ser útiles en pacientes de edad avanzada, mejorando de forma rápida los síntomas, sobre todo las alteraciones de conducta y del ritmo vigilia-sueño [10]. Por esto, cuando se considera que el mecanismo del SCA es la alteración del sueño, estos fármacos pueden ser útiles y se prefiere su uso nocturno. La dosis inicial de trazodona es de 25-50 mg oral (dosis máxima, 200 mg).
El tiapride es un antagonista selectivo de los receptores dopaminérgicos D2 y D3. Hay estudios en ancianos con SCA y en abstinencia alcohólica, pero no hay trabajos en UCI.
El metilfenidato es un fármaco psicoestimulante cuyo mecanismo de acción no es bien conocido. Se propone que actuaría aumentado los niveles de dopamina extracelular mejorando así el nivel de alerta, la capacidad de concentración y de atención. Existen algunos reportes eficacia en pacientes con SCA hipoactivo sin componente dopaminérgico (presencia de alucinaciones o ideas falsas). La dosis inicial es de 2,5 – 5 mg/12 horas por VO (máxima 10 mg/12 horas).
A continuación proponemos un diagrama de flujo de decisiones para el manejo del SCA en UCI.
Flujo de decisiones para el Manejo del SCA en UCI
6. Bibliografía
- Inouye SK. Delirium in older persons. N Engl J Med 2006;354(11):1157-1165..
- Pandharipande P, Cotton BA, Shintani A, Thompson J, Pun BT, Morris JA, Dittus R, Ely EW. Prevalence and risk factors for development of delirium in surgical and trauma intensive care unit patients. J Trauma 2008;65(1):34-41.
- Ely EW, Inouye SK, Bernard GR, Gordon S, Francis J, May L, et al. Delirium in mechanically ventilated patients: validity and reliability of the confusion assessment method for the intensive care unit (CAM-ICU). JAMA. 2001;286:2703-10.
- Dubois MJ, Bergeron N, Dumont M, Dial S, Skrobik Y: Delirium in an intensive care unit: a study of risk factors. Intensive Care Med 2001, 27:1297-1304.
- Ely EW, Stephens RK, Jackson JC, Thomason JW, Truman B, Gordon S, et al. Current opinions regarding the importance, diagnosis, and management of delirium in the intensive care unit: a survey of 912 healthcare professionals. Crit Care Med. 2004;32:106-12.
- American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders, 4th ed., Text revision. Washington DC, American Psychiatric Association 2000.
- Girard TD, Pandharipande PP, Ely EW. Review: Delirium in the intensive care unit. Critical Care 2008, 12(Suppl 3):S3 (doi:10.1186/cc6149).
- Peterson JF, Pun BT, Dittus RS, et al. Delirium and its motoric subtypes: a study of 614 critically ill patients. J Am Geriatr Soc 2006, 54:479-484.
- Tobar E, Romero C, Galleguillos T, et al. Versión en espanñol del método para la evaluación de la confusión en cuidados intensivos, estudio piloto de validación. Med Intensiva 2010;34(1):14–21.
- Palencia-Herrejón E, Romera MA, Silva JA. Delirio en el paciente crítico. Med Intensiva. 2008;32 Supl 1:77-91.
- Bergeron N, Dubois MJ, Dumont M, et al. Intensive Care Delirium Scrrening Checklist: evaluation of a new screening tool. Intensive Care Med. 2001;27:859-64.
- Palencia-Herrejón E. Diagnóstico del delirio en el enfermo crítico. Med Intensiva.2010;34(1):1–3.
- Chevrolet JC, Jolliet P. Clinical review: Agitation and delirium in the critically ill – significance and management. Critical Care 2007, 11:214 (doi:10.1186/cc5787).
- Strange K. Regulation of solute and water balance and cell volume in the central nervous system. J Am Soc Nephrol 1992 Jul;3(1):12-27.
- Han CS, Kim YK. A double-blind trial of risperidone and haloperidol for the treatment of delirium. Psychosomatics. 2004;45:297-301.
- Skrobik YK, Bergeron N, Dumont M, Gottfried SB. Olanzapine vs haloperidol: treating delirium in a critical care setting. Intensive Care Med. 2004;30:444-9.
- Ray WA, Chung CP, Murray KT, Hall K, Stein CM. Atypical antipsychotic drugs and the risk of sudden cardiac death. N Engl J Med. 2009;360(3):225-35.
- Devlin JW, Roberts R, Fong JJ, et al. Efficacy and safety of quetiapine in critically ill patients with delirium: a prospective, multicenter, randomized, double-blind, placebo-controlled pilot study. Crit Care Med. 2010;38(2):419-27
- Girard TD, Pandharipande PP, Carson SS, et al. Feasibility, efficacy, and safety of antipsychotics for intensive care unit delirium: the MIND randomized, placebo-controlled trial. Crit Care Med. 2010;38(2):428-37.
ANEXO - MÉTODO DE VALORACIÓN DE LA CONFUSIÓN PARA PACIENTES EN UCI (CAM-UCI)
1º PASO: evaluar el Nivel de Conciencia a través de la Escala de Ritchmond (RASS)
+ 4: combativo: violento, representa un riesgo inmediato para el personal.
+ 3: muy agitado: agresivo, se intenta arrancar tubos y catéteres.
+ 2: agitado: se mueve de manera desordenada, lucha con el respirador.
+ 1: inquieto: ansioso, sin movimientos desordenados, agresivos ni violentos.
0: despierto y tranquilo.
- 1: somnolencia: no completamente alerta, se mantiene despierto más de 10 seg.
- 2: sedación ligera: despierta a la voz y mantiene contacto visual menos de 10 seg.
- 3: sedación moderada: movimientos o apertura ocular a la voz, no dirige la mirada.
- 4: sedación profunda: se mueve o abre los ojos a la estimulación física, no a la voz.
- 5: coma no responde a la voz ni a la estimulación física.
Si la puntuación de la RASS es > -3, pasar al segundo paso del CAM-UCI
2º PASO: evaluar el Contenido de la Conciencia a través del CAM-UCI
1. Inicio agudo o curso fluctuante (A o B).
A. Cambio agudo en el estado mental sobre el estado basal.
B. Comportamiento fluctuante en las últimas 24 horas (por escala RASS o Escala de Glasgow).
2. Inatención.
Dificultad para fijar la atención, evidenciada por puntajes < 8 en cualquiera de los componentes visual o auditivo del Examen de Tamizaje para la Atención (ATE) Auditivo y Visual.
A. Examen auditivo: se leen 10 letras al paciente (ej. C D J M B B H A T V) y se le pide que, cuando reconozca una de ellas (por ejemplo, la “letra A”), nos apriete la mano. Se debe leer a una velocidad de una letra por segundo.
Se contabiliza un error cuando el paciente no aprieta la mano con la letra señalada (en el ejemplo, la letra “A”) y/o cuando el paciente aprieta la mano con cualquier letra diferente de las 10 posibles.
B. Examen visual:
1º Paso con 5 dibujos: se le muestran 5 dibujos de objetos comunes durante 3 segundos cada uno y se le pide que los recuerde.
2º Paso con 10 dibujos: se le muestra 10 dibujos (5 nuevos y los 5 del 1º paso) durante 3 segundos cada uno, y se le pide al paciente que diga o haga con mímica (asienta o niegue con la cabeza si está intubado o no puede responder) si reconoce o no los dibujos enseñados.
Esta prueba es evaluada por el número de respuestas correctas “sí” o “no” durante el 2º paso, de 10 posibles.
3. Pensamiento desorganizado
Pensamiento desorganizado o incoherente evidenciado por incapacidad para obedecer órdenes y/o respuestas incorrectas a 2 o más de las siguientes 4 preguntas (alternar diariamente grupo A y grupo):
Grupo A Grupo B
1. ¿Podría flotar una piedra en el agua? 1. ¿Podría flotar una hoja en el agua?
2. ¿Existen peces en el mar? 2. ¿Existen elefantes en el mar?
3. ¿Pesa más una libra que dos libras? 3. ¿Pesan más dos libras que una libra?
4. ¿Se puede usar un martillo para darle a un clavo? 4. ¿Se puede usar un martillo para cortar madera?
4. Nivel de Conciencia alterado
Presencia de un nivel de conciencia diferente al estado de alerta, tales como vigilante, letárgico, o estuporoso (es decir, RASS diferente de 0)
Para el diagnóstico de SCA por CAM-ICU se requiere
Criterios 1 y 2 + 3 o 4
|
|
|